来源:BioArt
原标题:李劲松/邹卫国合作利用“人造精子细胞”介导的半克隆技术实现小鼠骨发育的靶向遗传筛选
CRISPR-Cas9技术介导的突变筛选在小鼠和人细胞中已被广泛应用,而实现高效的小鼠个体水平遗传筛选对哺乳动物功能基因组研究具有重要意义。2019年7月2日, Plos Biology在线发表了中国科学院生物化学与细胞生物学研究所李劲松研究组和邹卫国研究组合作完成的研究成果 Targeted genetic screening in mice through haploid embryonic stem cells identifies critical genes in bone development 。该研究应用孤雄单倍体胚胎干细胞(“人造精子细胞”)介导的半克隆技术结合CRISPR-Cas9介导的基因编辑,成功实现了小鼠骨发育相关基因的个体水平遗传筛选,并揭示Irx5作为骨发育过程中重要调控因子,通过抑制PPARγ促进成骨分化并抑制成脂分化,为小鼠发育过程中关键基因功能研究开辟了新的途径。

此研究中,科研人员基于体外骨分化过程高通量测序分析数据筛选了72个潜在骨发育相关基因,建立了一个稳定表达Cas9同时携带216个sgRNA的单倍体干细胞(即“人造精子细胞”)文库(大部分的单倍体干细胞携带一个针对不同基因的sgRNA),并通过将文库中单倍体细胞逐一注射入小鼠MⅡ期卵母细胞的方法,获得了426只携带不同突变基因的半克隆小鼠。研究人员在其出生后第零天进行骨骼整体染色分析,依据骨骼大小、钙化、颅顶骨、长骨、椎骨形态等指标对每只小鼠进行评分;同时,通过对每只小鼠携带的sgRNA进行测序分析,研究人员定位了每只小鼠的潜在突变基因,并对骨发育异常小鼠所携带的靶基因进行测序分析确定其是否突变。通过这一筛选策略,研究人员从72个候选基因中筛选出4个参与骨发育调控的关键基因,其中Zic1和Clec11a已被研究证实参与骨发育调控,而Rln1和Irx5在小鼠骨发育过程中的功能尚未被报道。
为了验证Rln1和Irx5在小鼠骨骼发育中的调控机制,研究人员通过受精卵胞浆注射CRISPR-Cas9的方法,构建了Rln1和Irx5敲除的小鼠模型,发现Rln1敲除的小鼠仅在出生时表现为骨骼减小,而成年后差异不显著;Irx5敲除的小鼠在出生时和成年后均表现为显著的骨骼减小、骨量降低,同时伴随着骨髓中脂肪生成增加。机制探究表明,IRX5通过抑制PPARγ的激活促进成骨分化同时抑制脂肪生成。
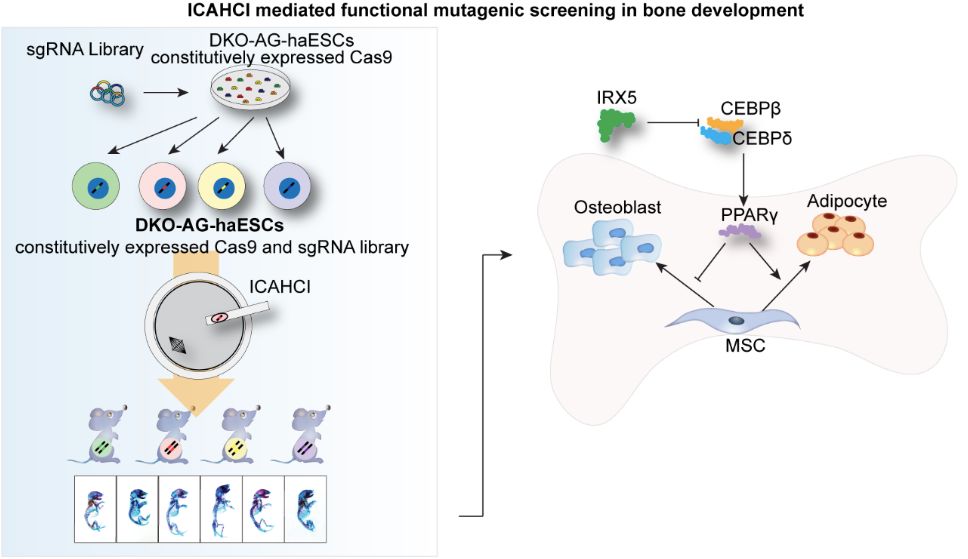
图1 “人造精子细胞”介导的半克隆技术实现小鼠骨发育的靶向遗传筛选
据悉,李劲松研究组的白梅竹博士和邹卫国研究组的韩玉娇博士为该论文的共同第一作者,李劲松研究员和邹卫国研究员为共同通讯作者。该研究得到了生化与细胞所陈洛南研究员课题组的大力支持。感谢GTP(全基因组标签计划)研发中心、生化与细胞所动物平台和细胞分析平台等的大力支持。
原文链接:
https://doi.org/10.1371/journal.pbio.3000350
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472129&idx=2&sn=c97bea744c5dc0264d932aa22ecd7117&chksm=84e210f5b39599e360fe3d9fcf5ab65ee6465778b96ddd015cb5653a906b3eb7352b228c47eb&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn