来源:BioArt
N6甲基腺嘌呤修饰,即m6A修饰,是真核生物mRNA上含量最多的修饰类型【1】,参与了mRNA分子经历的各个阶段,包括可变剪接、翻译、降解等,并调控神经发育、免疫应答、DNA损伤修复等生理过程【2-4】。
如今m6A是RNA表观遗传领域的研究热门,然而自1974年被鉴定【5,6】,m6A也坐了38年的冷板凳,最主要的原因是缺乏对mRNA上具体m6A修饰位点的鉴定方法。
2012年,基于m6A抗体的测序技术,包括m6A-seq, MeRIP-seq【7,8】的开发,使m6A修饰位点的鉴定得以实现,开启高通量测序对m6A修饰检测的研究热潮。该方法为理解m6A的分布和保守性立下汗马功劳,并促进了m6A的功能和作用机制研究。
然而基于m6A抗体的MeRIP-seq存在局限性:1.分辨率较低,只能确定100 nt左右的RNA片段中是否含有m6A修饰。虽然随后发表的许多研究对MeRIP-seq方法进行了不同程度的优化,试图提高MeRIP-seq的分辨率,甚至达到单碱基精度【9-14】,然而实际研究中仍然是MeRIP-seq使用更广泛;2.不能定量,即无法得知甲基化修饰的具体比例,m6A-LAIC-seq通过加入spike-in的方法来弥补这个缺陷;3.需要大量的样本投入用于免疫沉淀反应,不适于某些珍贵的样本如早期胚胎或病理样本,且实验步骤复杂。因此,需要开发快速准确且具有单碱基精度的m6A测序方法。
近日,Science Advance和Cell共同发文关注新型m6A 位点鉴定方法。
2019年7月4日,中山大学骆观正教授研究团队在Science Advance发表研究Single-base mapping of m6A by an antibody-independent method,报道了一种新的不依赖于抗体的高通量m6A检测方法 (m6A-sensitive RNA-Endoribonuclease-Facilitated sequencing, m6A-REF-seq)。

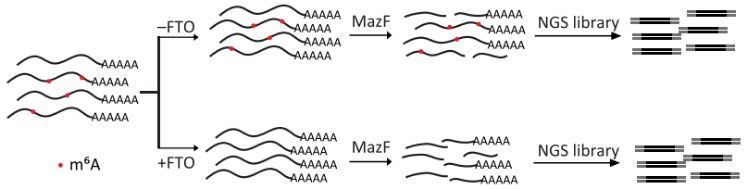
MazF是一种特异性地切割RNA上ACA motif的5'端,而不能够酶切带有m6A修饰的(m6A)CA motif的RNA内切核酸酶【15】。也就是说,MazF是否切割某段带有ACA序列的RNA,可反映该RNA是否携带m6A修饰。
基于此,研究者在MazF处理后,对酶切的mRNA片段进行修复、连接街头、PCR建库测序、通过分析酶切位点是在测序reads的内部还是端点来鉴定m6A修饰位点。为了降低假阳性,研究者使用m6A去甲基化酶FTO在体外处理mRNA作为负对照,只有在FTO处理组中甲基化比例降低的位点才被认为是准确的m6A位点(下图)。
使用m6A-REF-seq,研究者对HEK293T细胞系mRNA的m6A修饰进行鉴定,得到了4260个高置信度的m6A修饰位点,这些位点的分布与MeRIP-seq测序的结果非常相似,呈现出经典的在终止密码子附近富集的模式,且主要存在于经典的DRACA或RRACA motif中。
为了验证验证该方法的准确性,研究者使用基于连接酶的方法对部分位点进行了验证。主要步骤是针对特定m6A位点上下游设计probe,由于T3连接酶对m6A修饰位点存在位阻效应,连接效率低于正常A位点,再通过通用引物PCR的方法,即可在琼脂糖胶上验证该点是否是m6A修饰位点。同样以FTO处理样本作为负对照,m6A-REF-seq的准确性高于基于m6A抗体的测序方法,包括m6A-CLIP, miCLIP-CITS,miCLIP-CIMS和MeRIP,证明该方法有较高的准确性。
该研究通过使用MazF这种能够特异性区分m6A修饰的内切核酸酶,建立了m6A-REF-seq这个不依赖于抗体的m6A修饰检测方法,为m6A修饰位点的精确鉴定提供了新的方法。
无独有偶,6月27日以色列魏茨曼科学研究学院Schraga Schwartz组在Cell发表了论文Deciphering the "m6A Code" via Antibody-Independent Quantitative Profiling,同样利用MazF酶对m6A修饰的特异性识别,建立了检测m6A修饰的MAZTER-seq方法,使用了与骆观正研究组相同的建库策略。

在MAZTER-seq方法建立后,研究者对所鉴定的m6A位点进行了分析,期望寻找出m6A修饰位点的规律。确实,研究者发现m6A属于“硬编码”,即受本身RNA一级核苷酸序列的影响(in cis调控),可通过简单的方法对33%~46%的m6A位点进行预测。
同时,在MAZTER-seq测序分析中,研究者得到了两个具有争议的实验结果。
1.在小鼠胚胎干细胞分化过程中,整体m6A水平未发生变化。而2015年Jacob H. Hanna等在Science发表研究m6A mRNA methylation facilitates resolution of naïve pluripotency toward differentiation,发现METTL3介导的m6A修饰在胚胎干细胞分化中发挥重要功能。因此,研究者认为METTL3在mESC中发挥的重要作用并不是由于METTL3对m6A位点的重分配造成的,而是由于m6A信息解读的改变,比如,通过不同的阅读蛋白。
2.在敲低或过表达FTO后,整体m6A水平无明显变化。因此研究者认为FTO不是mRNA m6A去甲基化酶,而是snRNA m6Am的去甲基化酶。(编者注:事实上,关于FTO m6A去甲基化酶的争论一直存在,从m6A到m6Am,从mRNA到snRNA,FTO的作用底物经历了数次变革。详见BioArt报道: NCB | 这一次FTO是snRNA m6Am去甲基化酶)。
该研究在不依赖于m6A抗体的高通量测序方法MAZTER-seq的开发和建立的基础上,对m6A位点和其参与的生命过程进行了分析,对基于m6A抗体依赖的测序方法得到的研究成果提出了新的思考。
值得注意的是,这两篇文章几乎同时发表,但各有侧重。骆观正组的m6A-REF-seq更多关注的是m6A修饰位点定性的准确性,阐释了m6A-REF-seq拥有m6A定量的潜力,并探究了m6A修饰在物种间的保守性。而Schwartz组的MAZTER-seq在m6A定量方面做了很多工作,将m6A研究从定性领域推向定量领域。
然而,基于内切酶的m6A位点鉴定方法目前还存在限制。MazF酶只能识别ACA motif,而该motif只占m6A经典DRACH motif的16%左右,所以无论是m6A-REF-seq还是MAZTER-seq尚不能覆盖所有可能的m6A位点。
因此骆观正组还对其他存在于细菌TA系统中的RNA内切酶进行了筛选,筛选出能够识别UAC motif的ChpBK酶,说明细菌TA系统中的RNA内切酶可能都拥有识别m6A修饰的能力。同时也尝试突变MazF的特定位点以扩大其识别的序列范围,虽然突变的MazF酶对motif识别的结果并不理想,但是却保留了其对m6A甲基化的识别能力,说明识别m6A甲基化的能力可能是这一类内切核酸酶所共有,未来通过定向进化或者其他筛选方式有望找到更符合经典DRACH motif或直接识别A和m6A的内切核酸酶。
但同时,方法的建立还是为了解决实际问题,m6A领域有太多的争议,期待更完善的m6A位点鉴定方法的开发,让我们更全面的审视m6A。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0092867419306762;
https://advances.sciencemag.org/content/5/7/eaax0250
参考文献
1. Y. Fu, D. Dominissini, G. Rechavi, C. He, Gene expression regulation mediated through reversible m6A RNA methylation. Nat. Rev. Genet. 15, 293–306 (2014).
2. Y. Xiang, B. Laurent, C.-H. Hsu, S. Nachtergaele, Z. Lu, W. Sheng, C. Xu, H. Chen, J. Ouyang, S. Wang, D. Ling, P.-H. Hsu, L. Zou, A. Jambhekar, C. He, Y. Shi, RNA m6A methylation regulates the ultraviolet-induced DNA damage response. Nature 543, 573–576 (2017).
3. D. P. Patil, C.-K. Chen, B. F. Pickering, A. Chow, C. Jackson, M. Guttman, S. R. Jaffrey, m6A RNA methylation promotes XIST-mediated transcriptional repression. Nature 537, 369–373 (2016).
4. R. Winkler, E. Gillis, L. Lasman, M. Safra, S. Geula, C. Soyris, A. Nachshon, J. Tai-Schmiedel, N. Friedman, V. T. K. Le-Trilling, M. Trilling, M. Mandelboim, J. H. Hanna, S. Schwartz, N. Stern-Ginossar, m6A modification controls the innate immune response to infection by targeting type I interferons. Nat. Immunol. 20, 173–182 (2019)
5. Desrosiers R, Friderici K, Rottman F. 1974. Identification of methylated nucleosides in messenger RNA fromNovikoff hepatoma cells. PNAS 71:3971–75
6. Perry RP, Kelley DE. 1974. Existence of methylated messenger RNA in mouse L cells. Cell 1:37–42
7. Dominissini, D., Moshitch-Moshkovitz, S., Schwartz, S., Salmon-Divon, M.,Ungar, L., Osenberg, S., Cesarkas, K., Jacob-Hirsch, J., Amariglio, N., Kupiec,M., et al. (2012). Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature 485, 201–206.
8. Meyer, K.D., and Jaffrey, S.R. (2014). The dynamic epitranscriptome: N6-methyladenosine and gene expression control. Nat. Rev. Mol. Cell Biol.15, 313–326.
9. K. Chen, Z. Lu, X. Wang, Y. Fu, G.-Z. Luo, N. Liu, D. Han, D. Dominissini, Q. Dai, T. Pan, C. He, High-resolution N6-methyladenosine (m6A) map using photo-crosslinking-assisted m6A sequencing. Angew. Chem. Int. Ed. 54, 1587–1590 (2015).
10. B. Linder, A. V. Grozhik, A. O. Olarerin-George, C. Meydan, C. E. Mason, S. R. Jaffrey, Single-nucleotide-resolution mapping of m6A and m6Am throughout the transcriptome. Nat. Methods 12, 767–772 (2015).
11. S. Ke, E. A. Alemu, C. Mertens, E. C. Gantman, J. J. Fak, A. Mele, B. Haripal, I. Zucker-Scharff, M. J. Moore, C. Y. Park, C. B. Vågbø, A. Kusśnierczyk, A. Klungland, J. E. Darnell Jr., R. B. Darnell, A majority of m6A residues are in the last exons, allowing the potential for 3′UTR regulation. Genes Dev. 29, 2037–2053 (2015).
12. X. Li, X. Xiong, C. Yi, Epitranscriptome sequencing technologies: Decoding RNA modifications. Nat. Methods 14, 23–31 (2016).
13. W. Liu, J. Yan, Z. Zhang, H. Pian, C. Liu, Z. Li, Identification of a selective DNA ligase for accurate recognition and ultrasensitive quantification of N6-methyladenosine in RNA at one-nucleotide resolution. Chem. Sci. 9, 3354–3359 (2018).
14. N. Liu, M. Parisien, Q. Dai, G. Zheng, C. He, T. Pan, Probing N6-methyladenosine RNA modification status at single nucleotide resolution in mRNA and long noncoding RNA. RNA 19, 1848–1856 (2013).
15. Imanishi, M., Tsuji, S., Suda, A., and Futaki, S. (2017). Detection of N6-methyladenosine based on the methyl-sensitivity of MazF RNA endonuclease. Chem. Commun. (Camb.) 53, 12930–12933.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472063&idx=1&sn=a62de246168b24c7b78e79614ab080b9&chksm=84e2114bb395985de04895b33c84379a5ab7200d8f6dfcc7775785944abe342f29e89276b385&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



