来源:中国高科技
肺癌是全世界也是我国发病率和死亡率最高的恶性肿瘤。我国每年肺癌发病人数超过73万,死亡人数超过61万,五年生存率低至16.1%,肺癌已然成为“第一大癌症”与“头号癌症杀手”。转移是肺癌死亡率居高不下的重要原因。传统手术以及术后放化疗可以很好的控制原发肿瘤,但对发生转移的肿瘤往往束手无策。初步统计,95%以上的肿瘤死亡是由肿瘤转移造成的。因此,深入理解肿瘤转移的分子机制不仅有助于肿瘤早期转移的发现,还将为肿瘤转移的阻断提供新的策略,并最终改善癌症患者的预后。
代谢异常是恶性肿瘤的重要特征【1】。癌症相关基因的突变造成了细胞内多条信号通路的改变,从而影响肿瘤细胞的代谢,并重塑肿瘤细胞,以增强其存活和生长能力【2】。实际上,肿瘤细胞需要改变代谢的状态来应答癌基因信号通路传递的增殖信号。除此之外,异常的肿瘤微环境也能进一步改变肿瘤细胞的代谢表型,从而影响肿瘤的发生发展及对治疗的反应性。然而,这些异常的代谢如何支撑肿瘤转移却鲜为人知。
中科院上海生化与细胞研究所杨巍维课题组长期围绕肿瘤代谢异常功能与调控机制,重点关注肿瘤代谢与信号转导的交互调控,旨在揭示肿瘤细胞代谢重编程在肿瘤发生发展中的功能及调控机制,为癌症的诊治、药物研发等提供理论依据及研究基础 (Nature 2011, Cell 2012, Mol Cell 2012, Nat Cell Biol, 2013, Cell Res 2017, Mol Cell 2018, PLOS Biol 2018, Nat Commun 2016, 2019)。
6月27日,Nature在线发表了杨巍维课题组与中科院大连化学物理研究所李国辉课题组合作的题为UDP-glucose accelerates SNAI1 mRNA decay and impairs lung cancer metastasis的研究成果,研究首次揭示了糖醛酸代谢通路中的尿苷二磷酸葡萄糖(UDP-Glc)抑制肺癌转移的新功能及作用机制,为肺癌转移的监测和阻断提供了新的靶点和生物标志物。

在该项研究中,为了找到调控肿瘤转移的通路,杨巍维研究组在肿瘤细胞系A549中进行111种代谢相关限速酶的RNAi筛选,检测了A549细胞迁移情况。他们发现尿苷二磷酸葡萄糖脱氢酶(UDP-glucose dehydrogenase ,UGDH)敲除能显著抑制肿瘤细胞的迁移。UGDH是糖醛酸途径的限速酶,可以催化UDP-Glc反应生成尿苷二磷酸葡萄糖醛酸(UDP-GlcUA)【3】;后者可以作为细胞合成糖胺聚糖的原料(图1)。
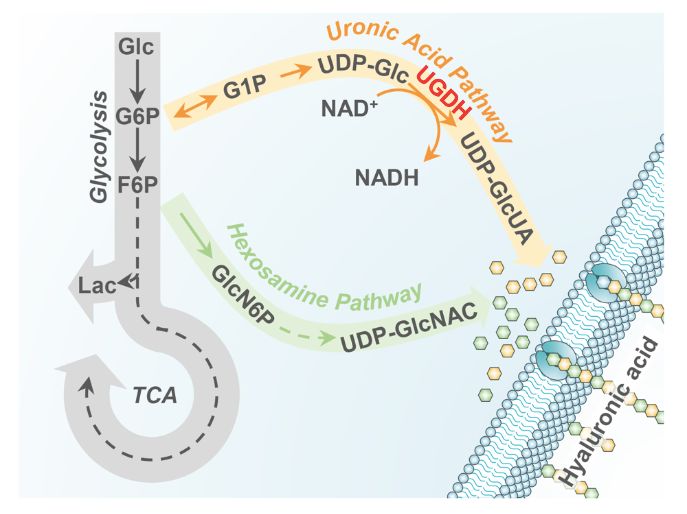
图1 糖醛酸途径。糖醛酸途径是糖酵解的分支通路。糖醛酸途径的原料来自于糖酵解的中间代谢产物葡萄糖6-磷酸。经过几步反应最终生成UDP-葡萄糖醛酸。UDP-葡萄糖醛酸与己糖胺途径(Hexosamine Pathway)生成的UDP-乙酰氨基葡萄糖一起用于糖胺聚糖,如透明质酸(Hyaluronic Acid, HA),等物质的生物合成。
他们继续检测了决定肿瘤转移的EMT (ephitellial-mesenchymal transition) 过程中相关14个基因的表达,发现UGDH表达下调能抑制SNAIL基因的表达。SNAIL是肿瘤转移中一个非常重要的基因【4】,它可调控多个EMT关键基因的表达,从而激活EMT。目前,相关研究已发现SNAIL可在转录、mRNA降解和SNAIL蛋白降解等多个步骤被调节。研究者发现在表皮生长因子受体(EGFR)激活的条件下,尿苷二磷酸葡萄糖脱氢酶(UGDH)第473位酪氨酸(Y473)发生了磷酸化。磷酸化的UGDH可与HuR结合,并将UDP-Glc转化为UDP-GlcUA。HuR蛋白结合于mRNA的3’端,能提高mRNA的稳定性。UGDH与HuR的结合,从而削弱了UDP-Glc对HuR与SNAI1 mRNA结合的抑制,增强了SNAI1 mRNA稳定性及蛋白表达;SNAI1表达的升高增强了肿瘤细胞迁移能力,进而促进了肺癌转移(图2)。
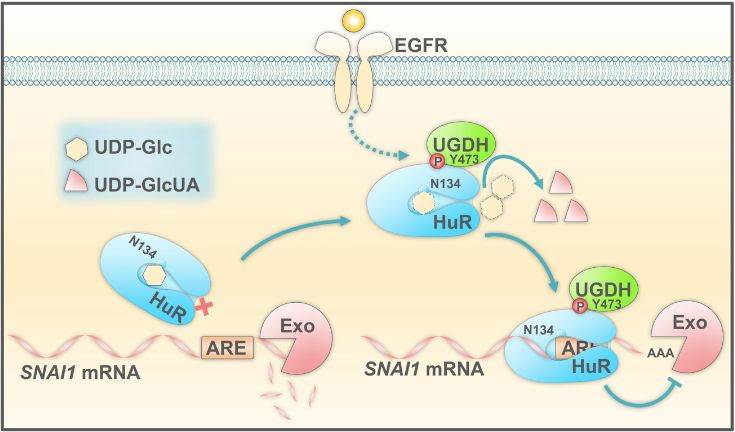
图2 UDP-Glc调控肺癌转移的模型。UDP-Glc与RNA结合蛋白HuR相互作用,竞争性抑制HuR对SNAI1 mRNA的稳定效应,从而抑制肺癌转移;EGFR信号激活可促使UGDH与HuR结合,并将UDP-Glc转化为UDP-GlcUA,从而解除了它对肺癌转移的抑制。
此外,UDP-Glc水平与肺癌患者的转移复发密切相关。研究者发现,相比原发灶,转移灶中肺癌组织的UDP-Glc水平急剧降低;更为重要的是,发生远端转移的肺癌患者的血液样本中含有更低的UDP-Glc水平。此外,他们还发现肺癌组织中UGDH Y473磷酸化水平越高,发生肺癌转移的几率越大,且患者的预后越差。
本研究揭示了UDP-Glc抑制肿瘤的新功能,建立了代谢小分子调控蛋白质功能的新模式,建立了细胞代谢与RNA稳定性调控的新连接,为肺癌转移的诊断和治疗提供了首个生化标志物及干预新策略。
据悉,本研究主要由中国科学院生物化学与细胞生物学研究所杨巍维课题组与大连化学物理研究所李国辉课题组合作完成。广州大学副教授王雄军、生化细胞所博士生刘瑞隆、朱文成、大连化物所楚慧郢为本文共同第一作者,杨巍维研究员和李国辉研究员为该论文的共同通讯作者。该项工作还得到了生化细胞所程红研究员,高栋实验室博士生李飞的指导与支持。
原文链接:
https://doi.org/10.1038/s41586-019-1340-y
制版人:珂
参考文献
1. Sullivan, L. B., Gui, D. Y. & Vander Heiden, M. G. Altered metabolite levels in cancer: implications for tumour biology and cancer therapy. Nat. Rev. Cancer 16, 680–693 (2016).
2. Boroughs, L. K. & DeBerardinis, R. J. Metabolic pathways promoting cancer cell survival and growth. Nat. Cell Biol. 17, 351–359 (2015).
3. Wegrowski, Y., & Pitsillides, A. A. (2014). UDP-glucose 6-dehydrogenase (UGDH). Handbook of glycosyltransferases and related genes, 1425-1437.
4. Peinado, H., Olmeda, D., & Cano, A. (2007). Snail, Zeb and bHLH factors in tumour progression: an alliance against the epithelial phenotype?. Nature reviews cancer, 7(6), 415.
来源:cas-hitech 中国高科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MDczMTAzMA==&mid=2650046625&idx=2&sn=e3c691d7b85b8ad1d3bbfe6caee22a0e&chksm=873874d8b04ffdce6e6df822231f99cf4d5d89a90ebf1a48f5be9e6b5464946108432e8272d1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



