来源:iNature
25岁的杰夫·卡罗尔(Jeff Carroll)在刚结婚6个月后,和妻子决定不要孩子了。因为他刚刚得知自己携带亨廷顿症的基因突变,这种遗传性疾病,会摧毁大脑和神经系统,最终往往导致死亡。他的母亲在四年前发病,他知道这个病迟早也会在自己身上爆发。
亨廷顿症(Huntington's disease),又称亨廷顿舞蹈症,是一种常染色体显性遗传性神经退行性疾病。 病因是患者第四号染色体上的 Huntington 基因发生变异,产生了变异的蛋白质,该蛋白质在细胞内逐渐聚集在一起,形成大的分子团,在脑中积聚,影响神经细胞的功能。一般患者在中年发病,表现为舞蹈样动作,随着病情进展逐渐丧失说话、行动、思考和吞咽的能力,病情大约会持续发展10年到20年,并最终导致患者死亡。
卡罗尔携带有一个拷贝的突变亨廷顿基因,因此,这个突变基因有50%的概率会传递给他的孩子,并导致发病,卡罗尔夫妇不愿意也不能冒这个险,因此下定决心不要孩子。
身为美国陆军下士的卡罗尔开始在军队中学习生物学知识,希望能够更深入地了解自己所患疾病。学习的过程中,他了解到了胚胎植入前遗传诊断的技术,也成为第三代试管婴儿,通过体外受精和胚胎筛查,卡罗尔夫妇就可以消除传递突变基因的可能性,他们决定试一试,最终于2006年成功诞下一对健康双胞胎。
卡罗尔一家
如今,杰夫·卡罗尔是西华盛顿大学的研究员,研究方向是CRISPR基因编辑。他一致力于使用强大的CRISPR基因编辑工具在小鼠中修正亨廷顿基因。
亨廷顿症仅仅由一个基因的突变,却带来巨大的破坏性,因此亨廷顿症被认为可以作为基因编辑人类胚胎的案例,一旦编辑成功,后代也将彻底摆脱亨廷顿症的困扰,这真的很强大。
但使用CRISPR改变人类胚胎基因的前景很难让人担忧,这里有一道巨大的道德伦理红线,人们想要迈过去,卡罗尔当然也想,但他认为必须非常谨慎谦虚的面对这些问题。他认为,CRISPR基因编辑胚胎对于个人健康和社会可能会产生许多意想不到的后果。在确保技术安全之前,可能还需要数十年的研究。
使用CRISPR基因编辑技术来预防和治疗疾病在公众舆论上非常火热,但科学家们却大多像卡罗尔一样保持沉默。2018年11月份,中国学者贺建奎使用CRISPR基因组编辑试图让儿童产生对艾滋病的抗性,许多科学家很快发声谴责这一不成熟和不负责任的举动。
贺建奎的基因编辑婴儿事件后,许多研究人员和科学家呼吁暂停可遗传的人类基因组编辑。可遗传基因编辑作为一种临床工具,虽然一些科学上的挑战可以克服,但大规模批准可能需要改变临床试验的运行方式,以及对该技术的更广泛共识。
多少错误才算多?
人类基因组编辑面临许多技术挑战,其中基因编辑导致的不必要的遗传基因改变(也就是所谓的脱靶效应)受到了最多的关注,然而脱靶效应可能是最容易克服的挑战。
目前最流行、效果最好的基因编辑方法是:CRISPR/Cas9的系统。这一基因编辑系统是从一些微生物抵御病毒的机制中改进而来,该系统使用向导RNA(gRNA)来指导Cas9酶进入基因组中的特定位点,Cas9酶在这一特定位点切割DNA。但Cas9酶也可能脱离特定位点,切割其他位点的DNA,这种“脱靶效应”可能会导致健康问题,例如,切割了抑癌基因就可能导致癌症的发生。
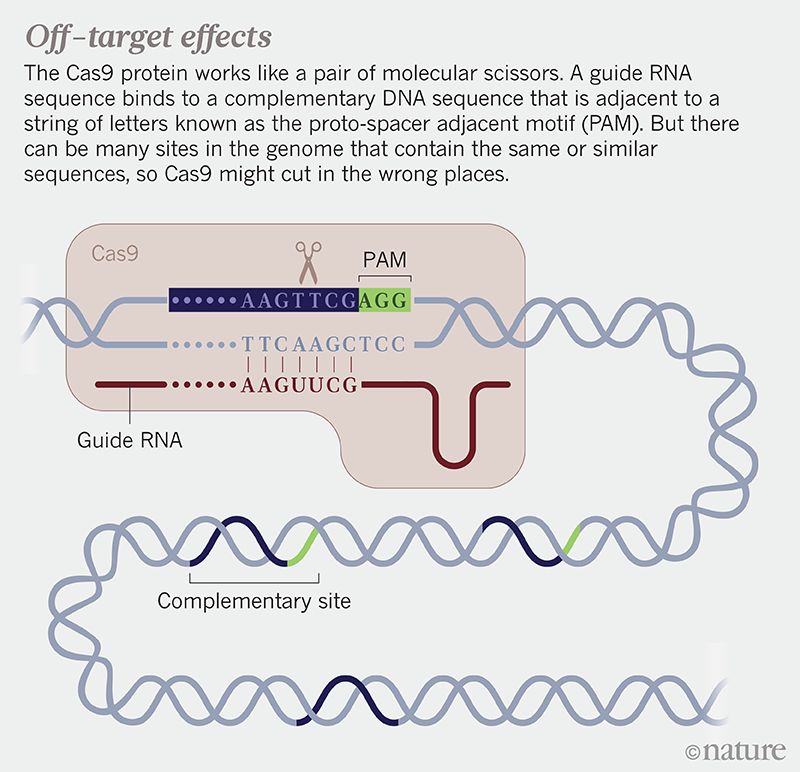
脱靶效应示意图,Cas9可能会切割其他类似位点
研究人员已经开始寻找脱靶效应更低,出错率更低的Cas9蛋白版本,并取得了许多不错的成绩。但是,很多时候错误率也取决于要编辑的基因位点所处的位置,而且许多研究是在小鼠上或人类细胞上进行的,小鼠细胞和人类细胞之间,人类成熟细胞和人类胚胎细胞之间的错误率可能并不相同。
并不需要把错误率降到0,因为人类细胞在自我复制时也存在一个低水平的错误率,有人认为,如果能治疗严重的疾病,那么一定程度的错误是可以接受的。
问题是,多少错误率才算多呢?基因编辑需要多高的精确度才足够呢?
2017年,俄勒冈健康与科学大学的 Shoukhrat Mitalipov 等人使用CRISPR/Cas9基因编辑在人类胚胎中来纠正与心力衰竭相关的基因变异,这些胚胎并未被植入到子宫。但后续其他研究人员未能成功重复这一实验结果。
CRISPR/Cas9基因编辑奠基人之一,加州大学伯克利分校的 Jennifer Doudna 教授认为,从这一点来看,我们并没有真正了解胚胎如何处理DNA修复,我们还需要做很多工作,才能理解这些基础知识。
研究人员一直在研究解决DNA修复相关问题的方法,2019年6月,Nature 和 Science 杂志同时发表了一种基于转座子的CRISPR系统,该系统可以将DNA插入基因组而不会破坏DNA双链,从而绕过对DNA修复机制的依赖。这一系统如果进一步证实有效,将大大增加基因插入的效率和安全性。详情点击:《科学》《自然》双重磅,基于转座子的新型CRISPR基因编辑横空出世
另一种方法是使用刘如谦等人开发的单碱基编辑器,单碱基编辑器同样不依赖DNA双链断裂,可以直接修改特定的单个碱基。但2019年4月份,来自中国和美国的几项研究表明,单碱基编辑器存在大范围的脱靶性。
什么样的基因编辑才是安全的?
基因编辑技术是美好的,但也可能是危险的,到底什么样的基因编辑才是安全的呢?
2017年,由美国国家科学院、工程院和医学院牵头制定了了一个编辑要植入的人类胚胎应该满足的条件。其中一个标准是:编辑产生的DNA序列已经在人群中普遍存在,并且没有已知的疾病风险。
仅此一项要求就将人类胚胎基因编辑工作判了死刑。因为CRISPR基因编辑不仅难以预测编辑的精确顺序,而且很难确定变体是否增加疾病风险。
第一个人类可遗传的CRISPR基因编辑尝试来自中国的贺建奎,他使用CRISPR/Cas9基因编辑创造了一对双胞胎婴儿,通过CRISPR/Cas9基因编辑敲除CCR5基因,希望让这对双胞胎获得对艾滋病的免疫力。
CCR5基因是艾滋病病毒HIV进入细胞的受体之一,一些欧洲人的CCR5基因天然缺失突变,他们往往不会感染艾滋病,然而CCR5基因在人体的具体作用尚不完全清楚,而且,亚洲人群中CCR5基因突变极其罕见,因此CCR5基因的删除并不一定能低抗亚洲的艾滋病病毒变体。
就在2019年6月份,Nature Medicine 刊登的一项研究表明,CCR5基因缺失会缩短寿命。
如何避免出现嵌合体胚胎
基因不仅在群体中的个体之间存在差异,而且在同一个体的细胞之间也存在差异,基因组测序揭示了这种镶嵌现象的普遍存在。
镶嵌现象可能会给基因编辑带来了问题,为了纠正导致亨廷顿基因而进行基因编辑后的胚胎可能是校正和未校正细胞的混合物。难以预料哪些细胞会影响由此产生的孩子的一生。
有研究表明,在受精卵阶段进行CRISPR/Cas9基因编辑,这是只是一个细胞,就避免了嵌合体的出现,但CRISPR/Cas9基因编辑的效率并不高,需要很多尝试才可能获得一个成功编辑的受精卵。

如何设计临床试验
如何在临床试验中测试可遗传的基因组编辑?该技术可以实现之前需要什么数据的?
这些都是必须要认真考虑的问题,因为这些基因水平的人为改变是永久性的,可以传递给后代,必须要慎之又慎。
英国现在允许线粒体捐赠,在体外受精时使用健康卵子来源的线粒体,以避免线粒体遗传病,英国人类受精和胚胎管理局在同意这一技术前,花了14年时间来分析来自动物和人的实验数据。而且至今这一技术的安全性仍然存疑,包括美国在内的多数国家仍不允许这么做。
更不用说试管婴儿技术花费了30多年才从实验室走向临床。
基因编辑的人体临床试验将带来许多新的挑战,比如,在技术被认为是安全的之前,需要对基因组编辑的儿童进行多长时间的跟踪观察? 研究人员将如何追踪这些孩子的孩子以研究跨代效应?
2019年5月22日,美国国家科学院、美国国家医学院和英国皇家学会宣布成立委员会,研究可遗传基因编辑的相关内容,并将于2010年发布报告,制定更加深入的标准。
世界准备好了吗?
尽管可遗传的基因编辑还存在相当大的科学障碍,但更难以解决的问题可能是道德和社会问题。
世界各地的科学界纷纷发表立场声明,反对对人类基因组进行可遗传编辑。美国国家科学院院士、美国国家医学院和皇家学会成员等都表示必须达成广泛的社会共识。
达成全球共识是一项艰巨的任务,目前大多数磋商都是在西方发达国家进行的,印度旁遮普大学的人类学家 Kewal Krishan 就表示,在印度几乎没有任何关于可遗传基因编辑的讨论。
英国皇家学会的一项公共调差表明,如果基因编辑被证明时安全的并且用于治疗遗传疾病,83%的人赞成使用遗传的基因编辑以治疗之前无法治愈的疾病。60的人反对使用可遗传的基因编辑来改善智力等做法。
科学家和伦理学家很容易在使用基因编辑以增强运动能力、改变眼睛颜色,与治疗和预防疾病之间作出区分。单即便如此,哪些疾病可能需要采用基因编辑来治疗仍然存在争议。
严重甚至致命的遗传疾病,例如亨廷顿症,一旦存在突变基因就必然发病,并导致死亡,这种疾病使用基因编辑来进行治疗并无争议。但是,对于编辑PCSK9这样的基因来预防高胆固醇并预防心脏病是否有必要呢?
尽管如此存在着这么多尚未解决的问题,依然有人想进行更多的基因编辑婴儿实验。2019年6月,一位俄罗斯科学家宣布他计划进行一项基因编辑婴儿实验。
据美国媒体STAT报道,在贺建奎宣布基因编辑婴儿后,迪拜的一家生育诊所就联系了贺建奎以寻求基因编辑方面的建议。
这个世界还没做好迎接基因编辑婴儿的准备,然而,人类却一直喜欢冒险(But humanity has always been adventurous)
参考内容:
https://www.nature.com/articles/d41586-019-01906-z
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247502300&idx=3&sn=542e02535d78eba870420d373049080a&chksm=fce6ba03cb9133157984cc7d0510613b8310d9f32e4d4e45dff3b7382ce40d1bbfbf575ee2f8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



