来源:BioArt
原标题:Cell | 泛素连接酶RIPLET激活RIG-I信号的新模式,否认了TRIM25在RIG-I泛素化修饰及信号激活中的作用
天然免疫是机体抵御病原微生物的入侵的第一道生理防线。病原入侵机体后,宿主天然免疫系统的模式识别受体(PRRs,pattern recognition receptors)识别病原体的病原相关分子模式(PAMPs,pathogen-associated molecular patterns),进而激活下游的信号通路接头蛋白,最终诱导I型干扰素(IFN)以及促炎因子的表达,进而促进抗感染免疫应答【1,2】。
在RNA病毒的入侵时,RIG-I(retinoic acid-inducible gene-I)能够识别胞质病毒RNA并产生I型干扰素(type I interferons,IFNs)及细胞因子【3】。RIG-I的分子结构中包含N端CARDs(caspase activation and recruitment domains, CARDs)结构域,DECH解旋酶结构域与C端CTD(C-terminal domain,CTD)结构域。
静息状态下的RIG-I处于自身抑制状态,其CARDs结构域结合于解旋酶结构域的插入区;当RNA病毒入侵后,CTD结构域感应并结合5’三磷酸双链RNA,使得RIG-I分子转变为开放构象释放CARDs结构域,释放的CARDs结构域会形成四聚体,并通过CARD-CARD相互作用招募MAVS成核(nucleate),介导下游信号的激活和免疫应答【4】。
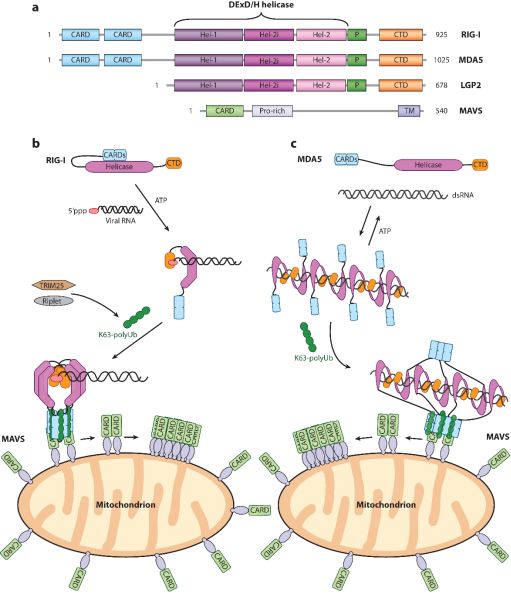
对RIG-I而言,63位赖氨酸泛素链(K63-Ubn chains)修饰在RIG-I的激活中发挥了重要作用。已有的报道指出,TRIM25和RIPLET(RNF135)是促进RIG-I信号激活中主要的泛素连接酶(E3 ligase),并且RIPLET和TRIM25以先后的顺序与RIG-I发生作用【5】。然而,对于RIPLET激活RIG-I的机制细节尚不清楚,同时TRIM25对RIG-I泛素化修饰及功能激活有待于进一步验证。
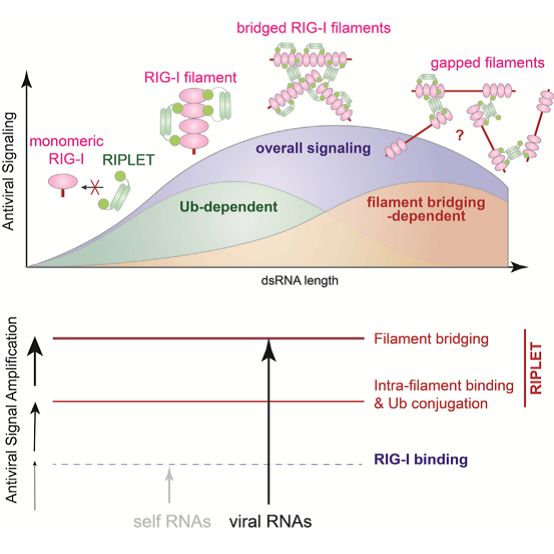
近日,来自美国哈佛医学院的Sun Hur课题组在Cell上发表题为Ubiquitin-Dependent and -Independent Roles of E3 ligase RIPLET in Innate Immunity的研究,研究人员通过细胞和生化的方法证明了RIG-I的泛素化修饰及激活依赖于RIPLET,同时否认了TRIM25在RIG-I泛素化修饰及信号激活中的作用。在与尚未形成RIG-I纤丝的“纤丝状寡聚体”结合时,RIPLET倾向于通过二聚体结构结合泛素化的RIG-I寡聚体;而对于形成纤丝的RIG-I,RIPLET则不依赖于泛素化方式,而是能够通过“搭桥”RIG-I纤丝,进一步放大RIG-I信号。

首先,研究人员通过基因敲除的293T细胞结合荧光素酶活性实验(luciferase activity assay)来研究RIPLET和TRIM25在RIG-I信号中的作用,结果发现RIPLET对于RIG-I信号激活是必需的。而在多种细胞(293T、MEF和A549)中,使用多种RIG-I配体(dsRNA、SeV、VSV、RVFV以及FluA)激活的结果表明TRIM25并不影响RIG-I的功能。
接下来,在RIG-I的63位泛素链修饰方面,通过体外泛素化实验(ubiquitination reaction in vitro)和体外MAVS激活实验(in vitro MAVS stimulation assay),研究人员发现在dsRNA存在的条件下,RIPLET能够将63位泛素链连接到RIG-I上,并且激活下游的MAVS形成纤丝(filament)结构。而在同样条件下,无论dsRNA存在与否,TRIM25都不能催化RIG-I发生泛素化修饰。
在分子机制上,为了探究RIPLET如何激活RIG-I,研究人员通过非变性凝胶迁移实验(native gel shift assays)结合截断体(truncation)实验,发现负责RIPLET二聚化的CC(central coiled coil)结构域对于结合RIG-I是必需的,并且该结合同时需要dsRNA的存在。这表明RIPLET通过二聚化的形式结合RIG-I。
为了进一步研究dsRNA的长度对于RIPLET与RIG-I的结合和泛素化修饰的关系。研究人员通过体外泛素化实验发现,只有在dsRNA长度大约为30–40 bp时,RIPLET泛素化修饰RIG-I的效率为最高。然而之前的报道指出,长度为40–200bp 的dsRNA更能有效的使RIG-I形成纤丝(filament)结构,进而引起RIG-I局部的高浓度,起到放大信号的作用【6】。因此,在长链dsRNA下,RIPLET与RIG-I的结合可能存在一种不依赖于泛素化修饰的机制。
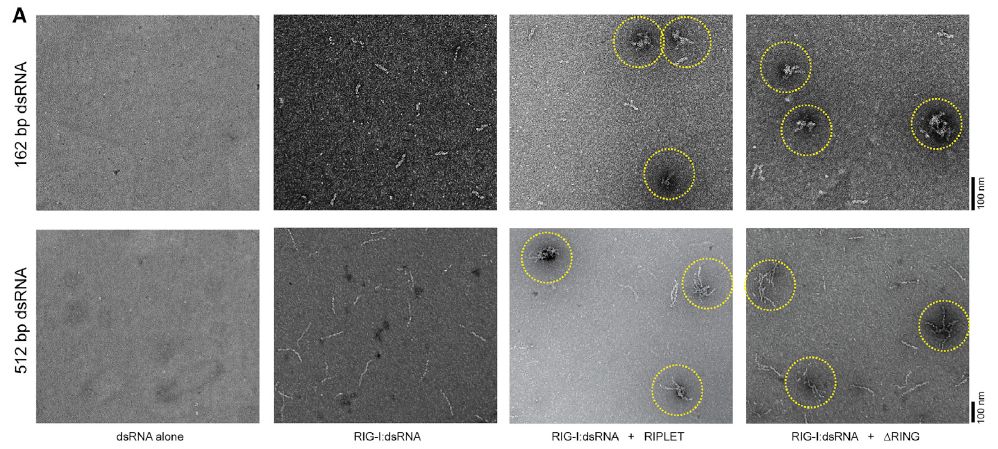
为了探究这一机制,研究人员通过negative stain EM和生物素标记RNA捕获实验(biotin-RNA pull-down assay)发现,无论是在体内还是体外的实验中,在长链dsRNA(162bp和512bp)存在下,RIPLET能够以“交叉搭桥”(Cross-Bridge)的方式连接RIG-I纤丝,并且这一过程不依赖于应激颗粒(stress granules,SGs)的形成。进一步对此进行功能分析表明,RIPLET“搭桥”RIG-I纤丝与RIG-I发生的63位泛素链修饰都能够增强RIG-I信号的活性,并且两者呈现出显著的协同效应。
综上所述,研究人员通过体外的生化实验结合细胞实验,证实了能够催化RIG-I发生63位泛素链修饰的的泛素连接酶是RIPLET而不是TRIM25。RIPLET以二聚体的形式结合RIG-I,并且在的短链dsRNA条件下,RIPLET倾向于结合并泛素化纤丝状的RIG-I寡聚体;而在长链dsRNA条件下,RIPLET则不依赖于泛素化,而是通过“交叉搭桥”的方式连接RIG-I纤丝,激活下游信号。本研究的结果揭示了泛素连接酶在天然免疫信号调控中的新机制,为其它受体的调控机制提供了新思路。
原文链接:
https://doi.org/10.1016/j.cell.2019.03.017
参考文献
1 Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell 2010; 140:805-820.
2 Hu MM, Shu HB. Cytoplasmic Mechanisms of Recognition and Defense of Microbial Nucleic Acids. Annual review of cell and developmental biology 2018; 34:357-379.
3. Hajishengallis, G., and Lambris, J.D. (2011). Microbial manipulation of receptor crosstalk in innate immunity. Nat. Rev. Immunol. 11, 187–200.
4 Wu, J.X., and Chen, Z.J. (2014). Innate Immune Sensing and Signaling of Cytosolic Nucleic Acids. Annu Rev Immunol 32, 461-488.
5 Oshiumi, H., Miyashita, M., Matsumoto, M., and Seya, T. (2013). A Distinct Role of Riplet-Mediated K63-Linked Polyubiquitination of the RIG-I Repressor Domain in Human Antiviral Innate Immune Responses. Plos Pathog 9.
6 Peisley, A., Wu, B., Yao, H., Walz, T., and Hur, S. (2013). RIG-I Forms Signaling-Competent Filaments in an ATP-Dependent, Ubiquitin-Independent Manner. Mol Cell 51, 573-583.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471271&idx=7&sn=bcce1e5bc705370a096fa29f2bfd2c5e&chksm=84e2ec53b3956545e5a3f12128722dd139e91a2f3d31ac3300e9fadfea270109b880423fd7ce&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn