来源:BioArt
原标题:Cell Host & Microbe封面文章 | 袁萌博士等揭示广谱抗体中和艾滋病病毒的新机制
艾滋病病毒 (HIV) 是一种逆转录病毒,可将自身的基因组整合进宿主的基因组,具有变异快、变化大等特点,极难清除。因此,发展预防性的手段至关重要,但艾滋病疫苗至今尚未研制成功。科学家从有些患者体内发现了广谱抗体,这些抗体可以中和体内的HIV。因此,如果能开发一种疫苗,能够激发机体产生广谱中和抗体,就能保护宿主不受HIV的侵染。
Env蛋白是HIV病毒表面唯一的一种蛋白,也是抗体能够中和HIV的最主要目标。因此,Env蛋白被认为是开发艾滋病疫苗的关键。其难点在于,Env蛋白的变异大,而且表面被多糖屏障保护,难以被抗体特异性结合。Env蛋白的作用是介导HIV与宿主细胞进行膜融合,进而实现对宿主的侵染。在膜融合的过程中,Env蛋白的融合肽 (fusion peptide, FP) 区域起到了关键的作用。融合肽在序列上相对保守,理论上来讲,是良好的抗原决定簇。2016年,科学家发现融合肽可被三种不同的人广谱中和抗体结合,包括PGT151 【1】、VRC34.01 【2】、ACS202 【3】,证实了融合肽是HIV的一个弱点区域。2018年,科学家使用融合肽免疫小鼠的实验【4】,进一步说明融合肽可能是产生有效疫苗的关键。
2019年6月12日,美国Scripps研究所Ian A. Wilson课题组(第一作者为袁萌博士)在Cell Host & Microbe上发表了题为Conformational plasticity in the HIV-1 fusion peptide facilitates recognition by broadly neutralizing antibodies的研究论文。通过X射线晶体学 (X-ray crystallography) 和冷冻电镜 (Cryo-EM) 等结构生物学手段,解析了ACS202抗体结合融合肽、ACS202抗体结合Env蛋白,以及VRC34.01抗体结合Env蛋白的结构,并系统比较了目前所有融合肽抗体结合的构象。研究发现,融合肽虽然被周围区域的氨基酸和多糖屏障保护,但从某些角度,抗体可以钻入多糖屏障,并结合融合肽,从而中和HIV病毒。每种抗体以不同的方向,结合不同角度和构象的融合肽。

融合肽抗体ACS202和VRC34.01分别中和45%和51%的菌株。本文探究了限制其广谱程度 (neutralizing breadth) 的因素。发现,HIV的融合肽区域相对保守,只有两个位点经常发生突变,且突变为相似的氨基酸。抗体VRC34.01结合HIV融合肽的方式,是形成结合口袋,紧紧包住其侧链,因此VRC34.01对融合肽突变敏感,不能耐受突变,这成为限制其广谱性的重要因素。相反,ACS202则以β-sheet的方式结合HIV融合肽,能够耐受其突变,但对附近区域的一个天然不保守的氨基酸E87的突变敏感,成为限制ACS202广谱性的因素。
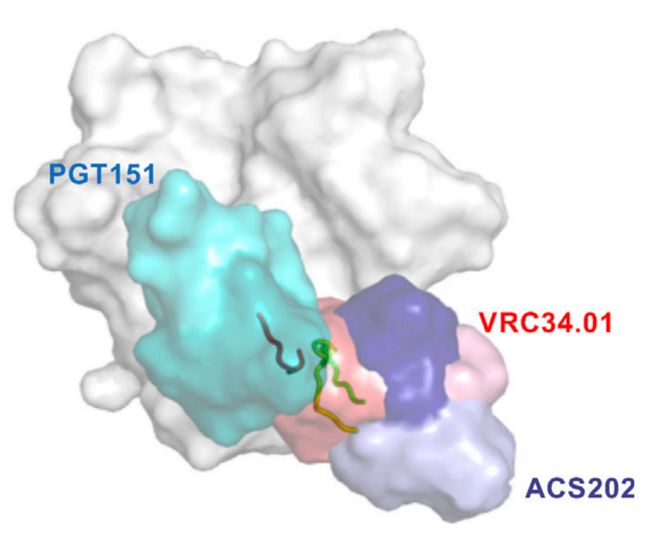
本文采用结构生物学手段,揭示了广谱中和抗体ACS202结合HIV Env蛋白的机理。发现ACS202抗体采用新的结合方向,钻入Env蛋白表面的多糖屏障,结合HIV关键的抗原决定簇——融合肽,从而广谱地中和HIV的侵染。该研究探讨了抗HIV融合肽抗体广谱性的限制因素,为HIV疫苗设计提供了新思路。
另,该文章已被评为当期封面文章。
原文链接:
https://doi.org/10.1016/j.chom.2019.04.011
参考文献
1. Lee, J.H., Ozorowski, G., and Ward, A.B. (2016). Cryo-EM structure of a native, fully glycosylated, cleaved HIV-1 envelope trimer. Science 351, 1043–1048.
2. Kong, R., Xu, K., Zhou, T.Q., Acharya, P., Lemmin, T., Liu, K., Ozorowski, G., Soto, C., Taft, J.D., Bailer, R.T., et al. (2016). Fusion peptide of HIV-1 as a site of vulnerability to neutralizing antibody. Science 352, 828–833.
3. van Gils, M.J., van den Kerkhof, T.L., Ozorowski, G., Cottrell, C.A., Sok, D., Pauthner, M., Pallesen, J., de Val, N., Yasmeen, A., de Taeye, S.W., et al. (2016). An HIV-1 antibody from an elite neutralizer implicates the fusion peptide as a site of vulnerability. Nat. Microbiol. 2, 16199.
4. Xu, K., Acharya, P., Kong, R., Cheng, C., Chuang, G.Y., Liu, K., Louder, M.K., O’Dell, S., Rawi, R., Sastry, M., et al. (2018). Epitope-based vaccine design yields fusion peptide-directed antibodies that neutralize diverse strains of HIV-1. Nat. Med. 24, 857–867.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471233&idx=6&sn=131f74d824e718ce3f913c42444f85fc&chksm=84e2ec75b3956563ecb7a176cfbac7a18d97e226819770409139b94c316a94d9bc529a198188&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn