来源:生物通
研究成果创造了利用冷冻电镜单颗粒方法解析至近原子分辨率生物大分子分子量最小记录。
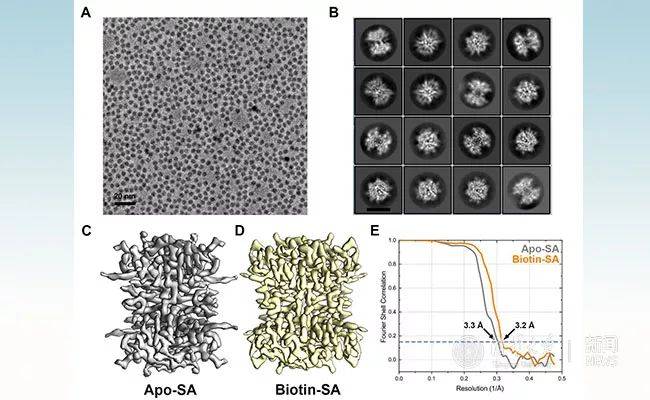
52 kDa链霉亲和素蛋白原始数据及三维重构示意图
近年来,冷冻电镜(cryo-EM)单颗粒分析技术(single particle analysis,SPA)成为结构生物学众多结构解析方法中异军突起的一支。目前的冷冻电镜单颗粒技术已经能较容易地将分子量大于300千道尔顿且生化性质稳定的蛋白质解析至近原子分辨率(约3 埃水平)。但由于小分子量蛋白质(一般为小于200千道尔顿)颗粒在冷冻样品中衬度不足等原因,小分子量蛋白质的高分辨解析工作对目前的技术手段而言仍然是很大的挑战。
清华大学生命科学学院王宏伟教授领导的研究组及合作者,在2019年6月3日于《自然·通讯》(Nature Communications)在线发表题为《分子量52千道尔顿的链霉亲和素蛋白的3.2埃分辨率冷冻电镜单颗粒三维重构》(Single particle cryo-EM reconstruction of 52 kDa streptavidin at 3.2 Angstrom resolution)的冷冻电镜方法学研究论文。该研究成果创造了利用冷冻电镜单颗粒方法解析至近原子分辨率生物大分子分子量最小记录。同时,该研究中发现了现有单颗粒样品中气液界面对蛋白分子颗粒性质影响的关键证据,对传统理论进行了有力的补充,也为未来方法学的发展起到积极的推动作用。
针对冷冻电镜技术缺陷,近年来一些新型电子光学硬件也开始投入使用,电压相位板(volta phase plate,VPP)是其中最具有代表性的新型硬件之一。电压相位板的应用能够大幅度地提升蛋白质颗粒在照片中的衬度,同时又能够保存有足够多的高分辨率结构信息用于后期三维重构。但目前还缺乏对电压相位板的系统性研究和使用经验,仍需要对该硬件的特性进行更详细地测试与开发,以期能广泛应用在小分子量蛋白解析工作中。
王宏伟实验室研究团队结合先前开发的球差校正器-电压相位板联用冷冻电镜成像系统(Fan et al., 2017)及单层大单晶石墨烯载网(Zhang et al., 2017)的冷冻样品制备技术对分子量大小为52千道尔顿的链霉亲和素蛋白进行结构解析,分别得到了该蛋白结合与未结合小分子生物素两种状态近原子分辨率的结构。这也创造了利用单颗粒技术解析近原子分辨率蛋白结构的分子量最小值新纪录。研究团队基于对数据的进一步挖掘与分析,推测该方法也可能适用于分子量小至39千道尔顿的蛋白质结构解析。
最后,研究团队还对链霉亲和素蛋白在气液界面和石墨烯表面的分布状态进行系统性研究,证明吸附在亲水化石墨烯表面的蛋白分子免于气液界面造成的分子结构变化,保存有更完整的结构信息。该结果是对气液界面假设的有力支持,同时也证明所建立的方法能够被更广泛地应用至小分子量蛋白质冷冻电镜研究中。
参考文献:
Single particle cryo-EM reconstruction of 52 kDa streptavidin at 3.2 Angstrom resolution
来源:gh_c1fce5726992 生物通
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675529564&idx=6&sn=4a5bbb2480815f7a10c2b56f34680a79&chksm=bc51fecd8b2677db2a46d2eaf10598e977358043d02a762f8acc231aad235cf43a89b1eabca9&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



