来源:中国医学科学院医学信息研究所
外泌体是(exosome)一种存在于细胞外的多囊泡体,可通过细胞内吞泡膜向内凹陷形成多泡内涵体,内涵体与细胞膜融合后释放其中的小囊泡。外泌体的直径在40-110nm之间,其中包含RNA、蛋白质、microRNA、DNA片段等多种物质,存在于血液、唾液、尿液、脑脊液和母乳等多种体液中。
外泌体从发现至今已有30多年的历史,虽然最初被认为可能是细胞的“垃圾”,所以才被排出来,但是近年来研究表明外泌体具有功能活性并可进行细胞间信息传递。如今,研究已经发现外泌体在抗原提呈细胞中呈递抗原程中、肿瘤细胞发生发展、神经细胞信号转导过程中都发挥着重要作用。
血液中的外泌体携带肝癌特征性的RNA变化新闻来源:Exosomes from Blood Carry RNA Signatures of Liver Cancer根据2019年3月31日在佐治亚州亚特兰大市举行的美国癌症研究协会(American Association for Cancer Research, AACR)年度会议上提供的初步数据,RNA测序可能有助于医生更早地诊断肝细胞癌(hepatocellular carcinoma, HCC)。
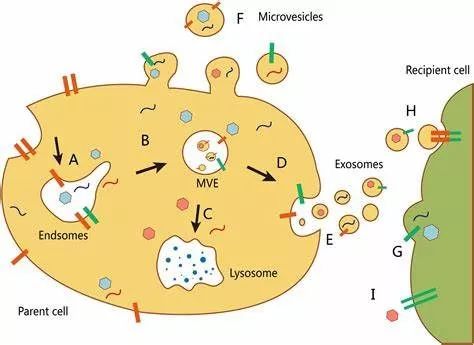
图片来自Frontiers in Pharmacology, 2017, doi:10.3389/fphar.2017.00300。
美国西奈山伊坎医学院血液学家、肿瘤学家Augusto Villaneuva和他的团队收集了15名患者的血液样本:10名患有肝癌,5名患有肝硬化但没有患癌症。他们开发出一种方法来分离血液中的外泌体---携带蛋白或遗传物质的微小囊泡---以便比较它们的内含物。他们发现,与那些没有患上癌症的患者相比,来自癌症患者的外泌体中的某些RNA显著增加。Villanueva团队在美国癌症研究协会年度会议上提供了这15名患者的数据,并希望对来自150名志愿者的外泌体进行测序,以便确定这种趋势是否具有一致性。随着开发更好的筛查方法,他们希望理解这些外泌体的构成可能会导致新的疗法。他问道,“那些外泌体是否是功能性的呢?”他想知道RNA的变化是否会让外泌体更具“攻击性”或可能改变肿瘤。 “这将是这个研究项目的下一个自然步骤,但是现在还为时尚早。”
Cell:重磅!抑制外泌体PD-L1可诱导全身性的抗肿瘤免疫反应doi:10.1016/j.cell.2019.02.016一类称为免疫检查点抑制剂的免疫治疗药物彻底改变引发了癌症治疗变革:许多直到最近还被认为无法治疗的恶性肿瘤患者正在经历长期缓解。但是,大多数患者对这类药物没有反应,而且它们对某些癌症的治疗效果要比其他癌症好得多,其中的原因令科学家们困惑不解。如今,在一项新的研究中,来自美国加州大学旧金山分校的研究人员发现了一个令人惊讶的现象,这或许可以解释为什么许多癌症对这些药物没有反应,并提出了激活免疫系统对抗疾病的新策略。相关研究结果发表在2019年4月4日的Cell期刊上,论文标题为“Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory”。在恶性肿瘤组织中,一种称为PD-L1的蛋白起“隐形斗篷”的作用:癌细胞通过在其表面上展示PD-L1来保护自己免受免疫系统的攻击。一些最成功的免疫治疗药物通过干扰PD-L1或它的受体PD-1---位于免疫细胞表面上---起作用。当PD-L1和PD-1之间的相互作用受到阻断时,肿瘤就会失去躲避免疫系统的能力,并且变得易受抗癌免疫攻击。某些肿瘤可能对这类免疫疗法有抵抗力的一个原因是它们不会产生PD-L1,这意味着现有的免疫检查点抑制剂无法发挥作用---也就是说,它们可能会使用其他的迄今尚未发现的免疫检查点蛋白来避免免疫系统的识别。科学家们此前已发现PD-L1蛋白在前列腺癌患者的肿瘤细胞中以低水平或完全不存在的方式存在着,这可能解释了它们对这类免疫疗法的抵抗力。但是,在这项新的研究中,Blelloch及其团队针对这一点提出了一个非常不同的答案:他们发现PD-L1是由这些肿瘤大量生产的,不过癌细胞不是在它们的表面上展示这种蛋白,而是通过一种称为外泌体的分子货轮输出PD-L1。这些包被着PD-L1的外泌体从癌细胞上脱落下来,并通过淋巴系统或血液流到淋巴结,即免疫细胞经激活后保护身体的部位。在那里,PD-L1蛋白充当流动的分子破坏者,远程解除免疫细胞的武装,并阻止它们确定肿瘤的位置以发起抗癌攻击。因此,外泌体携带的PD-L1(下称外泌体PD-L1)不是关闭肿瘤表面的免疫反应,而是在它们到达那里之前抑制免疫细胞。与在肿瘤表面发现的PD-L1不同的是,外泌体PD-L1由于不明原因,对现有的免疫检查点抑制剂具有抵抗性。 Blelloch说,“现有的流行看法是PD-L1作用于进入肿瘤微环境(tumor niche)中的免疫细胞,在这种肿瘤微环境中,免疫细胞会遇到这种免疫抑制蛋白。我们的数据表明,对于许多对免疫疗法产生抵抗性的肿瘤来说,情况并非如此。这些肿瘤通过将外泌体PD-L1传递到淋巴结中来躲避免疫系统,它们在淋巴结中远程抑制免疫细胞的激活。这些发现代表着对现有教条的打破。”
Cell:新研究指出应重新评估外泌体的组成doi:10.1016/j.cell.2019.02.029小胞外囊泡(small extracellular vesicle)的异质性和非囊泡胞外物质的存在引起了关于外泌体(exosome)的内含物和功能性质的争论。在一项新的研究中,来自美国范德堡大学的研究人员采用高分辨率密度梯度分离和直接免疫亲和捕获方法来精确地描述外泌体中的RNA、DNA和蛋白组分以及其他的非囊泡物质。相关研究结果发表在2019年4月4日的Cell期刊上,论文标题为“Reassessment of Exosome Composition”。
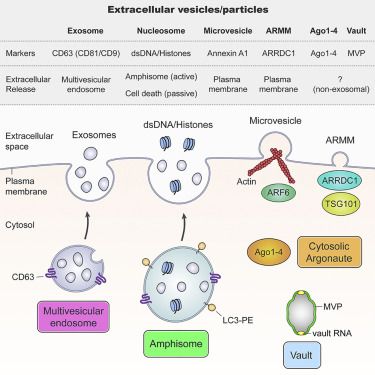
图片来自Cell (2019), doi:10.1016/j.cell.2019.02.029。
这些研究人员发现胞外RNA、RNA结合蛋白和其他的细胞蛋白在外泌体和非囊泡区室中发生差异性表达,而且他们并没有在外泌体中检测到Argonaute 1、Argonaute 2、Argonaute 3、Argonaute 4、糖酵解酶和细胞骨架蛋白。再者,这些研究人员将膜联蛋白A1(annexin A1)鉴定为直接从从质膜脱落下来的微囊泡(microvesicle)的一种特异性的标志物。他们进一步发现小胞外囊泡并不是DNA积极释放的载体。相反,他们提出一种通过一种依赖于自噬和多泡核内体(multivesicular endosome)但不依赖于外泌体的机制积极分泌胞外DNA的新模型。 由此可见,这项新的研究表明需要重新评估外泌体的组成,这就为更清楚地了解胞外囊泡的异质性提供一种框架。
Science:脂肪细胞释放的含脂质外泌体竟能调节巨噬细胞doi:10.1126/science.aaw2586; doi:10.1126/science.aaw6765在一项针对小鼠的新研究中,来自美国哥伦比亚大学和罗格斯大学的研究人员发现脂肪组织释放出一种充满脂质的颗粒,这种颗粒在免疫功能和代谢中起作用。相关研究结果发表在2019年3月1日的Science期刊上,论文标题为“A lipase-independent pathway of lipid release and immune modulation by adipocytes”。论文通讯作者为哥伦比亚大学瓦格洛斯内科与外科医学院预防医学教授Anthony Ferrante Jr.博士。这些研究人员发现脂肪细胞不仅释放出甘油三酯中的脂肪酸成分,它们还释放出包装成小颗粒的完整甘油三酯。这些称为脂肪细胞外泌体(adipocyte exosome, AdExo)的填充着脂质的颗粒被脂肪组织中的巨噬细胞摄取。巨噬细胞快速地降解AdExo中的甘油三酯并释放出 脂肪酸。Ferrante猜测释放出的脂肪酸被脂肪细胞在脂质循环中摄取,从而为脂肪细胞重新供应新的脂质。Ferrante指出,“在骨骼中存在一种类似的机制:破骨细胞(osteoclast)---另一种类型的巨噬细胞---将骨骼降解成钙和磷酸盐,用于制造新的骨骼。这种循环 对骨骼健康至关重要。我们如今想知道一种类似的循环是否存在于脂肪组织中以维持它的健康。”此外,这些研究人员发现AdExo似乎控制着免疫细胞的发育。科学家们对巨噬细胞如何产生组织特异性功能没有一个清晰的认识。但是,Ferrante和他的团队发现AdExo可能在“教育”免疫细胞方面发挥核心作用,诱导骨髓细胞发育成巨噬细胞,所产生的巨噬细胞经指导 后消化和循环利用脂质。
PLoS Pathog:引起卡波西肉瘤的病毒会劫持外泌体调控肿瘤微环境doi:10.1371/journal.ppat.1007596一项由北卡罗莱纳大学(University of North Carolina,UNC)莱恩伯格综合癌症研究中心的研究人员完成的最新研究表明一种和癌症相关的病毒可以劫持宿主的细胞包裹,从而促进肿瘤周围环境的改变。这项研究于近日发表在《PLOS Pathogens》上,该研究表明卡波西肉瘤相关的疱疹病毒能够霸占宿主细胞用于输送物质到周围环境的包裹系统。这些包裹叫做细胞外囊泡(或者外泌体),其中包含的物质可以引起周围细胞发送信号的方式、移动方式以及其他效应的改变。“我们的研究表明卡波西肉瘤相关的疱疹病毒使用外泌体对肿瘤周围的环境进行了重塑。”该研究通讯作者、UNC医学院微生物学和免疫学教授Dirk Dittmer博士说道。“这种病毒可以在不感染细胞的情况下完成这个过程。相反的是,肿瘤环境周围的细胞会被这些病毒修饰后的外泌体攻击。这导致信号传递被激活、细胞因子释放以及细胞基因表达谱的重置。”
Blood:研究发现细胞交流的新方式doi:10.1182/blood-2018-09-874552细胞生物学科学家们对细胞产生的一种叫做细胞外囊泡的小脂质囊泡非常感兴趣,因为研究已经发现这种囊泡介导了细胞之间的交流。现在Tom Carter教授课题组已经发现了血管内皮细胞存储和释放细胞外囊泡的新通路。该小组与弗朗西斯·克里克研究所的Peter Rosenthal博士合作,主要聚焦于一种叫做外泌体的特殊细胞外囊泡。
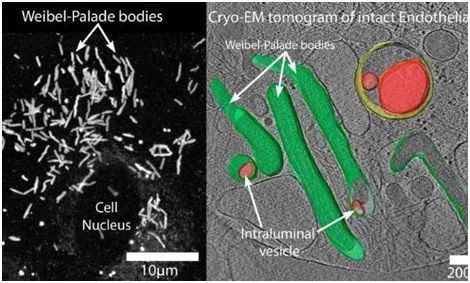
图片来源:St. George's University of London。
Carter教授研究小组发现Weibel-Palade body (WPB)外排的过程也会释放外泌体。WPB是一种特殊的分泌颗粒,包含凝血因子、血管假性血友病因子和一系列涉及对抗感染的炎前因子。来自WPB的外泌体的结构和其他外泌体的结构不同,这表明这种外泌体被释放到循环系统中也许有其他特殊的功能。目前研究人员正在试图找到这些外泌体的特殊功能。Carter教授说道:“我们通过先进的冷冻电子成断层扫描技术发现了WPBs中的脂质囊泡。同时使用高速荧光成像直接观察了活的内皮细胞的WPB内部囊泡以及它们作为外泌体被释放的过程。”
Nat Microbiol:利什曼原虫或会利用特殊的病毒交流机制来扩散doi:10.1038/s41564-018-0352-y近日,来自麦吉尔大学的科学家们通过研究发现,一种感染特殊病毒的利什曼原虫(Leishmania parasite)或会通过一种细胞通讯机制来进行扩散,相关研究结果刊登于国际杂志Nature Microbiology上,该研究有望帮助研究者开发引发严重缺陷的感染的新型疫苗。研究者发现,利什曼原虫的RNA病毒1(LRV1)能够隐藏在外泌体(exosomes)中,利什曼原虫能利用这种病毒来进行交流。研究人员首次证实了非包膜的双链RNA病毒能利用较低等的真核生物外泌体来获得包膜结构,通过隐藏在这种“交流系统”中,病毒就能免于外界威胁,同时也能促进病毒对其它利什曼原虫细胞进行感染。研究者表示,当寄生虫被LRV1感染时,利什曼原虫病例也会变得更具侵袭性,本文研究结果或能为研究者提供一种新型模型来研究病毒的生物学特性以及调节病毒从宿主细胞中释放的机制;利用包含这种病毒的利什曼原虫外泌体或能帮助开发一种有效抵御圭亚那利什曼原虫的有效疫苗。
Cancer Res:科学家鉴别出一种能有效抑制乳腺癌生长和扩散的特殊蛋白doi:10.1158/0008-5472.CAN-18-0842近日,一项刊登在国际杂志Cancer Research上的研究报告中,来自路易斯安那州立大学的科学家们通过研究发现了一种特殊蛋白或能抑制乳腺癌的生长和扩散,相关研究结果有望帮助开发改善乳腺癌治疗的新型疗法或策略。这项研究中,研究者调查了蛋白质Nischarin在外泌体释放过程中的重要功能,外泌体是一种纳米尺寸的囊泡结构,其中包含有蛋白质、遗传物质和其它参与生理学和病理学过程的物质等;肿瘤衍生的外泌体包含多种细胞间通讯的信号分子,这些信号分子能参与肿瘤的进展以及癌症的转移,肿瘤中的外泌体会影响肿瘤微环境中多种类型细胞间的相互作用,并能调节肿瘤的发育、进展以及转移,原发性肿瘤释放的外泌体则能增强癌细胞的“播种”及生长转移。研究者指出,Nischarin能够调节细胞的吸附并改变外泌体的特性,来自Nischarin阳性细胞中的外泌体能够减少乳腺癌细胞的运动性和粘附性,以及肿瘤的体积;而且Nischarin阳性细胞还会释放较少的外泌体,从而就会降低细胞的存活率;将乳腺癌细胞和Nischarin阳性细胞的外泌体进行共培养会降低肿瘤的生长和肺部转移。
Cell:来自活化PMN细胞的外泌体竟是导致慢性阻塞性肺病的致病元凶doi:10.1016/j.cell.2018.12.002慢性阻塞性肺病(COPD)是世界上第四大死因。在一项新的研究中,来自美国阿拉巴马大学伯明翰分校的研究人员发现了一种新的之前未报告过的将慢性炎症与COPD患者的肺部损伤之间关联在一起的致病实体。相关研究结果发表在2019年1月10日的Cell期刊上,论文标题为“Activated PMN Exosomes: Pathogenic Entities Causing Matrix Destruction and Disease in the Lung”。

图片来自Cell, doi:10.1016/j.cell.2018.12.002。
这种致病实体是由活化的多形核白细胞(polymorphonuclear leukocyte, PMN)分泌的外泌体(exosome)。外泌体是一种微小的亚细胞颗粒。当将从活化的PMN细胞收集的外泌体灌注到健康小鼠的肺部中时,它们导致COPD肺部组织损伤。值得注意的是,这些研究人员还收集了来自人类COPD患者和新生的患有支气管肺发育不良的重症监护病房婴儿的肺液中的外泌体;当将这些来自人体的外泌体灌注到健康小鼠的肺部时,它们也会引起COPD肺部组织损伤。这种损伤主要来自人肺部PMN细胞分泌的外泌体。 论文通讯作者、阿拉巴马大学伯明翰分校肺病、过敏症与危重病医学教授J. Edwin Blalock博士说,“这份研究似乎提供了第一个证据表明一种确定的非传染性亚细胞实体在从人体转移到小鼠时能够再现疾病表型。我认为这可能是一个意义非常深远的发现。我们在这项研究中发现的很多东西将适用于其他组织,这取决于疾病。”
Nat Cell Biol:科学家有望开发出抑制癌症转移的新型疗法doi:10.1038/s41556-018-0256-3近日,一项刊登在国际杂志Nature Cell Biology上的研究报告中,来自瑞士洛桑联邦理工学院的科学家们通过研究阐明了癌细胞抵御化疗发生扩散的详细分子机制,当对肿瘤模型进行研究后,研究者发现,两种常用的化疗药物:紫杉酚和多柔比星能够诱导乳腺肿瘤释放外泌体,在化疗治疗下,这些外泌体会包含膜联蛋白-A6(annexin-A6),而膜联蛋白-A6并不会存在于未治疗的肿瘤所释放的外泌体中,研究者表示,在外泌体中装载膜联蛋白-A6或许会显著增强机体对化疗的反应。当从化疗治疗的肿瘤中释放后,外泌体就会在血液中循环,当达到肺部后这些外泌体就会释放其内容物,其中就包括膜联蛋白-A6,这就会刺激肺部细胞释放名为CCL2的蛋白质,进而吸引机体中的单核细胞发挥作用。免疫反应实际上非常危险,此前研究结果表明,单核细胞会促进肺部中癌细胞的存活和生长,而这就是癌症发生转移的一个关键阶段,本文研究中研究人员鉴别出了化疗和乳腺癌转移之间的新型关联。研究者De Palma说道,接受辅助化疗的乳腺癌患者机体癌细胞的外泌体中膜联蛋白-A6的水平会发生增加,但研究者并不知道是否膜联蛋白-A6也会对人类乳腺癌产生任何促转移的活性。更为重要的是,研究者发现,在化疗期间中和膜联蛋白-A6或阻断单核细胞的功能就能有效抑制实验性的乳腺肿瘤转移到肺部组织中,相关研究结果或能帮助改善辅助化疗手段的效率和安全性;研究者表示,如今在临床中已经开发出了多种单核细胞的抑制剂,因此应该将其与辅助化疗手段相结合来潜在地抑制外泌体所介导的未知副作用的产生。
Cancer Res:同济医学院学者发现巨噬细胞分泌外泌体促进结直肠癌转移侵袭doi:10.1158/0008-5472.CAN-18-0014临床和实验证据都表明肿瘤相关巨噬细胞能够促进癌症发生和进展,但是到目前为止巨噬细胞如何调节结直肠癌转移还没有得到完全揭示。最近来自华中科技大学同济医学院的王桂华等人发现M2型巨噬细胞能够通过分泌外泌体与结直肠癌细胞进行交流影响癌细胞的迁移和侵袭,相关研究结果发表在国际学术期刊Cancer Research上。在这项研究中,研究人员首先发现M2巨噬细胞调节的结直肠癌细胞迁移和侵袭依赖M2型巨噬细胞分泌的外泌体。进一步的分析表明这种巨噬细胞来源的外泌体中包含高水平的miR-21-5p和miR-155-5p,并且巨噬细胞来源外泌体介导的结直肠癌细胞迁移和侵袭都依赖这两个miRNA。随后研究人员又从机制上进行了研究,他们发现巨噬细胞通过外泌体将miR-21-5p和miR-155-5p转移到结直肠癌细胞内,然后这两个分子与BRG1编码序列结合,下调BRG1的表达水平,之前研究已经证实BRG1是促进结直肠癌转移的关键分子,该分子在发生转移的结直肠癌细胞内会发生表达下调。总得来说,这些结果表明M2型巨噬细胞在癌症的恶性进展阶段诱导结直肠癌细胞进行迁移和侵袭,并通过影响BRG1表达应答肿瘤微环境。结直肠癌细胞和M2型巨噬细胞之间的动态相互对话为治疗发生转移的结直肠癌提供了新的可能。
来源:IMICAMS 中国医学科学院医学信息研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzUxNzc5MzUwNw==&mid=2247484562&idx=1&sn=69242541a02a4b7a0618a128946bc710&chksm=f993f71ecee47e08868181e9ac3040cf059d631c934dc9188355a5770db44e284618b8ade2ef&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn