来源:ScienceAAAS
原标题:解析寡基因遗传中遗传修饰子的“三板斧”—家系外显子组测序、基因编辑小鼠模型、人诱导多能干细胞|Science述评
评述论文:Oligogenic inheritance of a human heart disease involving a genetic modifier(Science 31 May 2019: Vol 364, Issue 6443)
人类遗传病按照致病基因位点数量,可归为单基因遗传(single gene inheritance)、双基因遗传(digenic inheritance)、寡基因遗传(Oligogenic Inheritance)、多基因遗传(polygenic inheritance)。其中,寡基因遗传通常多指代某种遗传病具有3个致病基因位点共同导致。在致病基因位点中,有些导致主要的表型改变,另外一些影响表型出现的早晚及程度等,被称为遗传修饰子(genetic modifer)。传统寡基因遗传研究中确定遗传修饰子的主要限制包括:1)临床表型需要长期监测和难以全面准确评估症状表型:因为疾病症状发生早晚不同、种类存在个体差异、表现轻重不一,长期追踪方能排除由监测时间不够长导致的表型定义不准确;容易忽视非典型症状的出现,遗漏相关遗传修饰子带来的改变;对典型病理改变需要准确的定量评价体系,否则难以准确评估病变严重程度,妨碍修饰基因作用的确定。2)非遗传因素的干扰:环境因素的存在同样会干扰症状出现的早晚与严重程度,难以区分基因的作用还是环境的影响(1)。
以往确定遗传修饰子的研究中,有的会假定遗传修饰子与主要致病基因位点在基因组上存在同一连锁区域,两位点会由父代同时传递给发病子代,于是在疾病家系中找寻与已知主要基因连锁的候选其他位点;或者通过已知的分子通路筛选可能影响已知主要基因作用的候选基因、根据蛋白质互作证据结合病理生理表现构建基因网络,在发病人群中寻找网络中不同基因同时出现的致病位点。在本期一项研究中,美国加州大学旧金山分校格拉斯通研究所(Gladstone Institute-UCSF)的Deepak Srivastava教授带领团队成功把家系的全外显子测序、Crispr-Cas9基因编辑小鼠模型、患者的人诱导干细胞(hiPS)三者结合起来,在一个左室心肌致密化不全(left ventricular noncompaction, LVNC)家系中确定一个少见的NKX2-5基因变异(NKX2-5A119S)为其两个主要致病基因变异(MYH7 L387F 和 MKL2Q670H)的遗传修饰子,为遗传研究中针对人群海量单核苷酸变异在疾病发生中的机制研究提供了新路径(2)。
在该家系中,发现该病从父代到子代出现症状加重的趋势:患儿的父亲仅表现出较轻的LVNC症状,但两个患儿中,一个两个月大时就出现充血性心力衰竭,另外一个四岁也有未被注意的LVNC症状。此外,对其以往在24周流产的胎儿进行分析,也发现具有心脏异常。研究人员认为新生突变(de novo mutation)不能解释该病的高外显率(Penetrance),因而把重点放到一些人群频率较低(MAF < 0.005)的变异上来,并结合多种预测工具筛选出遗传自父亲的8个候选单核苷酸变异(SNV),进一步参考转录本数据挑选出可能在心脏组织中起作用的2个变异(MYH7 L387F 和 MKL2 Q670H)(图1A),并利用同样的方法筛选到遗传自母亲的唯一一个变异(NKX2-5 A119S)(图1B)。
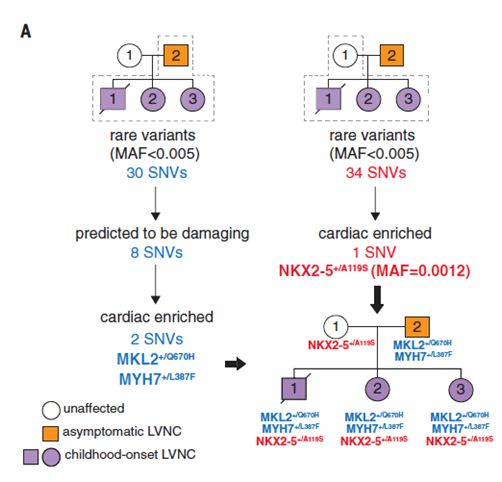
图1. 候选变异的筛选
为了评估3个变异的致病性,研究人员首先利用CRISPR-Cas9基因编辑技术构建了基于C57BL/6小鼠的模型,并证明三个变异在传递过程中符合孟德尔遗传。Myh7+/L387F纯合子小鼠在胚胎发育到10天左右出现心力衰竭而死;出生后4天的MKL2+/Q670H纯合子小鼠出现类似LVNC变化;NKX2-5 A119S纯合子小鼠胚胎期心腔壁出现异常变薄。三者的纯合子都可以导致心室发育异常,但造成的轻重明显不一:MYH7 L387F和MKL2Q670H作用更为明确,NKX2-5 A119S单独造成的改变并不十分明显。接下来三种突变的复合杂合子模型成功展示出单个杂合变异不能造成明显的形态学改变(图2A),但随着三个变异累加,模型表现出更薄的心腔壁(图2B)、更薄的心尖(图2C)、更深的小梁(图2D)。可以看出,MYH7 L387F 和 MKL2Q670H在累加NKX2-5 A119S之后表现出最严重的致病性改变,后者的出现使得症状显著加重,因而结合其单独发生不造成明显表型变化的观察结果,研究人员将它作为遗传修饰子。此外,研究者利用转录组测序(图2E-F),确定三突变小鼠模型中上调表达基因多与早期发育相关,与其心肌组织处在不成熟的状态相吻合;下调表达基因多参与上皮细胞发育和冠状动脉形成,与以往研究中认为LVNC中上皮细胞功能受损符合。
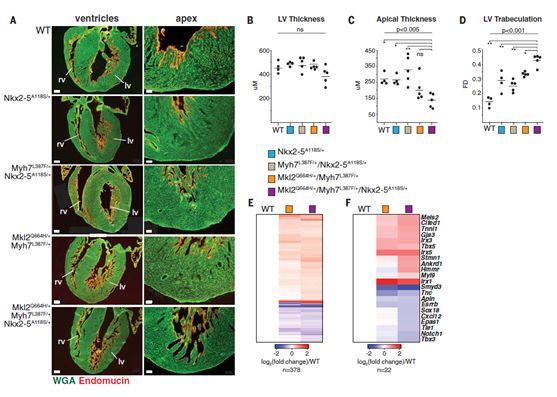
图2. 基因编辑小鼠模型的表型改变
为了验证小鼠模型中结论是否适用于人,研究者将患者的人诱导多能干细胞转化为心肌细胞(hiPS-CM),研究其表型变化(图3A)。上述小鼠模型的表型改变多为组织层面,在细胞水平可以对应分析的,只有Mkl2基因改变影响细胞粘附能力的表型作为评价指标。因而研究者在此阶段首先展示了患者hiPS-CM的异常聚集(图3B-C)。不过,上一步小鼠模型转录组测序数据中的的特征性差异表达基因,为此步评估提供了巧妙的切入点:对患者的hiPC-CM同样进行转录组测序,也发现了相同的特征基因表达变化,为三突变同样可导致人体组织中的改变供了重要证据(图3D)。此外,研究人员还利用Chip-Seq技术对NKX2-5可能调控的基因进行了分析(图3E)。
研究团队创新结合不同热门技术手段,形成了探索遗传修饰子的完整路径,为从个体内数以百万计的SNVs中探寻其相互作用提供可行的新思路,将引发领域内更多尝试,从而更好地理解基因型和表型间的相互作用,促进精准医学的不断发展。
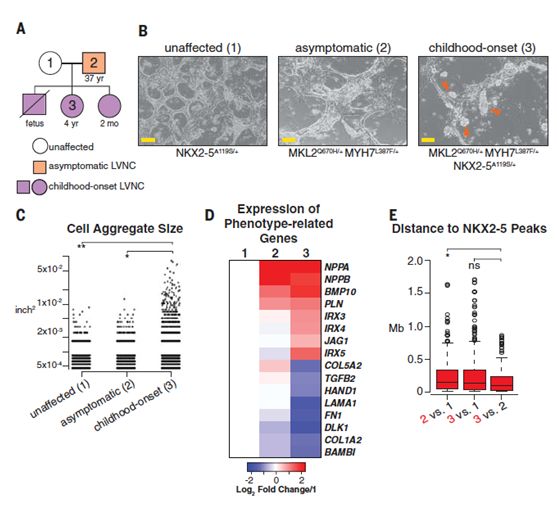
图3. HiPS-CM的表型变化
作者简介:张大可中国遗传学会遗传咨询分会高级遗传咨询师,主要从事医学转化基因组学相关研究。
参考文献
1. Kousi M, Katsanis N. Genetic modifiers and oligogenic inheritance. Cold Spring Harbor perspectives in medicine, 2015, 5(6): a017145.
2. Gifford, GA et al. Oligogenic inheritance of a human heart disease involving a genetic modifier, 2019.364(6443).
来源:Science-AAAS ScienceAAAS
原文链接:http://mp.weixin.qq.com/s?__biz=MzI3NDY3NzQ2Mg==&mid=2247487166&idx=5&sn=cfe825199d26ed5d12aeb7dbb2c07ad8&chksm=eb112507dc66ac110ebabe487c7594839d2423005a336346a4b1dc1b075e59f9b5dfb0645375&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn