来源:清华大学医学院官网
原标题:JEM | 清华大学刘云才团队揭示E3泛素化连接酶VHL调控滤泡辅助性T细胞发育和功能的新机制
2019年5月23日,清华大学医学院刘云才课题组在Journal of Experimental Medicine期刊上在线发表了题为“The E3 ligase VHL promotes follicular helper T cell differentiation via glycolytic-epigenetic control”的文章,揭示了VHL-HIF1a信号通路通过糖酵解途径调控滤泡辅助性T细胞的发育和功能,为感染性疾病以及自身免疫疾病的治疗提供了新思路。
滤泡辅助性T(Tfh)细胞在有效体液免疫的形成、高亲和力抗体的生成以及对病原体的清除的过程中发挥着重要的作用。滤泡辅助性T细胞定位于B细胞滤泡中,并向B细胞提供多种信号包括细胞因子和表面相互作用等以形成生发中心,其中生发中心B细胞将经历多轮增殖、体细胞高频突变、亲和力成熟、抗体类型转换,最终分化成具有高亲和力的浆细胞和能长时间存活的记忆B细胞。滤泡辅助性T细胞由幼稚T细胞发育而来,其分化发育过程是一个由多种信号或因子综合调控的多阶段的过程。滤泡辅助性T细胞的发育和功能异常都有可能导致免疫缺陷型疾病或自身免疫疾病等的发生。
细胞缺氧反应和代谢调节对各种免疫细胞的发育和功能的调控均有重要意义。哺乳动物细胞中,VHL-HIF1a信号通路可以响应于局部氧气水平的变化,并进一步通过调控细胞内基因转录包括细胞糖代谢相关基因等,来使细胞适应于不同的氧环境。以前已有报道在不同的生理或炎症条件下,不同的淋巴组织或淋巴细胞所处的氧环境大相径庭。特别是生发中心极度缺氧。然而,目前尚不清楚VHL-HIF1a信号通路是如何调控B细胞滤泡以及生发中心内滤泡辅助性T细胞的发育和功能的。
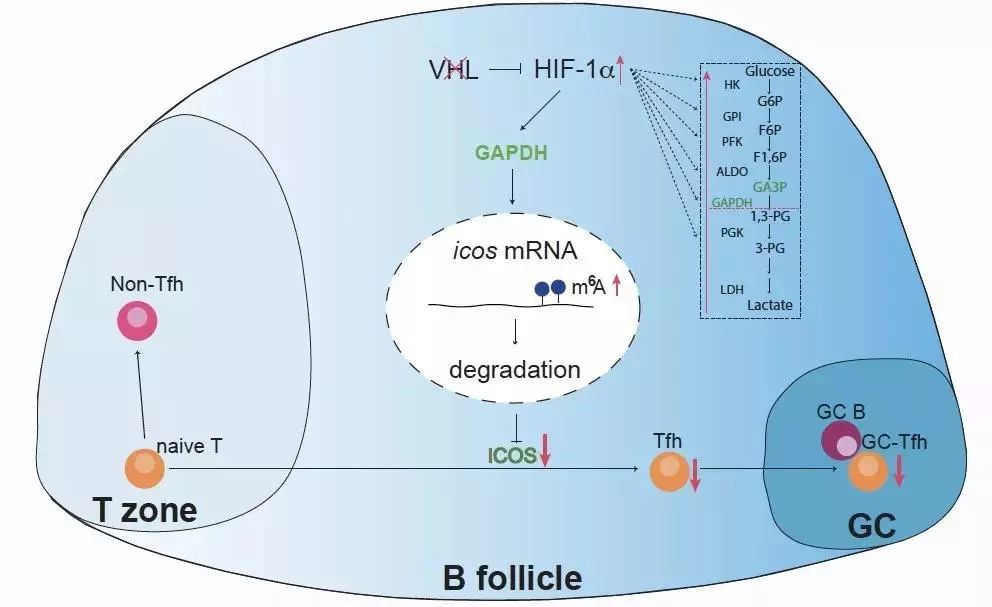
近年来,缺氧诱导因子HIF以及葡萄糖代谢作为免疫领域的研究热点,被广泛报道参与免疫细胞发育和功能的调控。刘云才课题组一直致力于蛋白泛素化参与调控免疫系统和控制免疫性疾病发生的研究。本研究着眼于HIF上游调控蛋白E3泛素化连接酶VHL,揭示了缺氧反应所依赖的葡萄糖代谢通过表观遗传修饰调控滤泡辅助性T细胞的新机制。本研究鉴定出糖酵解途径代谢酶GAPDH作为VHL-HIF1a信号通路下游关键靶点来调控滤泡辅助性T细胞的发育起始。GAPDH可以通过促进icos mRNA上的m6A修饰来降低ICOS基因的表达水平,从而抑制滤泡辅助性T细胞的早期发育。这一工作在先前发现的VHL调控调节性T细胞稳态、ILC2发育以及肺部巨噬细胞功能的工作基础上,进一步阐明了VHL-HIF1a信号通路以及糖酵解途径对免疫细胞的调控作用,为探索基于该通路的新型药物的发现奠定了理论基础。

原文链接:
http://jem.rupress.org/content/early/2019/05/22/jem.20190337
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247501579&idx=6&sn=7267261c3b00b59eac55cbd904e572cf&chksm=fce6b4d4cb913dc2cef8785273753c5b4ce14559f589c10cff2a3a7ccc77fdb5de7adf140b65&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


