来源:BioArt
线粒体拥有自己的基因组,被称为mtDNA(mitochondrial DNA),该基因组随着母系遗传。mtDNA的高突变率和低重组率驱动雌性生殖细胞系中产生了一套独特的“自然选择”机制,以防止有害的突变在体内的累积。但是,对于这种自然选择机制是如何发挥作用的还知之甚少【1】。
突变mtDNA的选择作用最初出现在果蝇卵子发生早期,由Mitofusin蛋白触发的,随后线粒体基因组物理分相然后碎片化。一旦发生碎片化,线粒体产生ATP的能力就会下降,随后被清除掉。为了检测生殖细胞系中突变mtDNA的选择,作者们设计并发展了非常巧妙的荧光标记的DNA探针,该探针能够特异性结合Drosophila melanogaster(随后简称为M种果蝇,是突变型)或者是Drosophila yakuba(随后简称为Y种果蝇,是野生型)mtDNA的D-loops区域(图1)。M种果蝇的细胞色素c氧化酶组分I(CoIts)包含一个温度敏感型的点突变。可以将Y果蝇的线粒体移植到M种果蝇中,从而人为地建立了一个同时包含野生型mtDNA和突变型mtDNA的杂合品系的果蝇。这种果蝇可以直接使用mtDNA特异的荧光原位杂交(FISH)的方式来观察和分析体内mtDNA的选择。

图1 野生型与突变型mtDNA探针的原理
果蝇的卵巢包含两种细胞:一种是生殖细胞,能够产生卵子和下一代;另一种是体细胞,包围在生殖细胞周围的细胞(图2)。
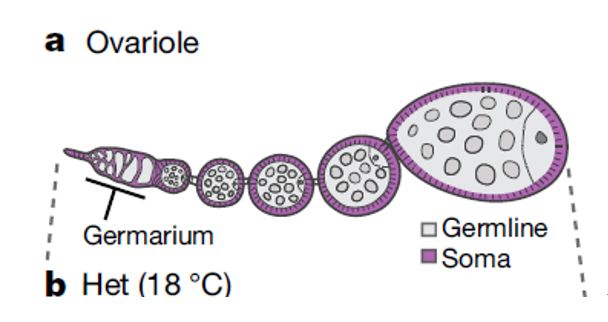
图2 果蝇卵巢模式图。外围紫色细胞标示体细胞,中心代表生殖细胞。
在低温条件下,野生型的mtDNA与突变型mtDNA同时存在,而且由于是野生型果蝇的线粒体移植到突变型果蝇中,因此突变型的mtDNA的FISH信号表现更高更明显。而到高温条件下,生殖细胞中的野生型mtDNA相对于突变型的比例明显升高(图3),而体细胞中并没有什么明显的变化。因此,说明此种选择特异地发生在生殖细胞中。而且由于雄性生殖细胞中的mtDNA并不遗传,通过实验也证明了在雄性果蝇睾丸中并没有明显的选择作用发生。由此可以确认此选择作用特异地发生在雌性生殖细胞系之中。
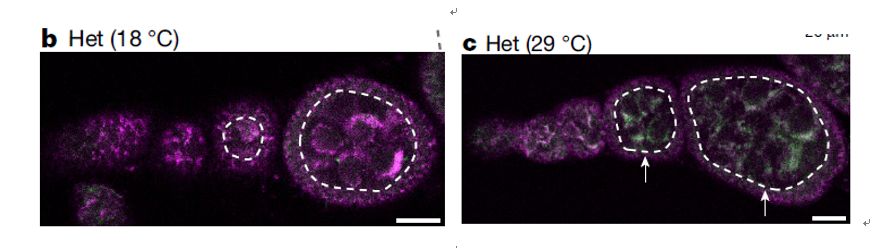
图3 生殖细胞中低温下野生型与突变型mtDNA同时存在,高温下突变型mtDNA发生选择作用而被清除。(紫色代表突变型mtDNA,绿色代表野生型mtDNA)
生殖细胞系中mtDNA的选择作用最终结果一般认为是引起细胞凋亡。但是,通过过表达细胞凋亡抑制因子p35之后发现并不会完全阻塞选择作用。但是通过表达AOX氧化酶能够大范围内关闭选择作用,说明生殖细胞系中mtDNA的选择作用依赖于氧化磷酸化作用。那么除此之外,是否还有其他因素影响线粒体mtDNA的选择作用呢?与其他的细胞器不同的是,线粒体能够发生融合和分裂【2】,因此作者们想要知道,线粒体的融合和分裂引起的线粒体形态学方面的变化对于mtDNA的选择作用是否有一定的影响。通过光激活的GFP标记线粒体后发现,在生殖干细胞中的光激活线粒体会迅速地与周围的线粒体交换内容物,而分化后产生的包囊细胞则不会发生与周围线粒体的交换。因此,线粒体的融合和分裂对于mtDNA的选择有一定的影响,并且通过遗传操纵促进线粒体融合或者分裂的因子同样会改变突变型mtDNA的含量。因此,碎片化的mtDNA对于选择作用的发生是非常重要的。
但是mtDNA一旦碎片化之后,突变型的线粒体是如何被识别和清除的过程了解的还不甚清楚。线粒体基因组编码的蛋白一般与对质子动力势(Proton motive force, PMF)以及ATP合成相关。因此,突变型mtDNA被认为可能会影响PMF以及ATP的合成。为了检测PMF对于线粒体DNA选择作用的直接影响,作者们首先在体内通过遗传学方式来储存PMF,但是发现PMF的维持对于mtDNA的选择作用没有明显的影响。但是作者们发现,减少线粒体ATP对于选择作用是必须的。
干细胞中的线粒体DNA碎片化后会造成突变型mtDNA含量的显著降低。因此,作者们想要知道线粒体自噬信号途径是否会参与到mtDNA选择作用中。作者们发现减少自噬信号途径主要的调控因子Atg1的表达会直接阻塞选择作用的发生,而自噬信号途径中的其他因子比如Atg8则对选择作用没有明显的影响。除此之外,根据前人的研究发现红细胞成熟过程中线粒体的清除需要线粒体外膜蛋白BNIP3L的作用【3】。通过将果蝇中BNIP3L同源基因BNIP3敲低后发现,会显著的抑制选择作用的发生。这与已有的报道结果一致,分化产生的包囊细胞中的BNIP3显著升高【4】。因此,线粒体DNA的碎片化后的清除依赖于自噬信号途径的Atg1以及线粒体外膜蛋白BNIP3的参与。
总的来说, Hurd与Lehmann研究组关于线粒体DNA的选择作用的研究,解决了一直以来人们所关注的生殖细胞系里mtDNA碎片化如何驱动以及有毒有害的突变累积的mtDNA如何被清除的问题,为mtDNA引起的相关疾病提供了可供参考的治疗思路。
参考文献
1. Palozzi, J.M., Jeedigunta, S. P. & Hurd, T. R. Mitochondrial DNA Purifying Selectionin Mammals and Invertebrates. Journal of molecular biology 430,4834-4848, doi:10.1016/j.jmb.2018.10.019 (2018).
2. Lee,H. & Yoon, Y. Mitochondrial fission and fusion. Biochemical Society transactions 44, 1725-1735, doi:10.1042/BST20160129 (2016).
3. Schweers,R. L. et al. NIX is required forprogrammed mitochondrial clearance during reticulocyte maturation. Proceedings of the National Academy ofSciences of the United States of America 104, 19500-19505, doi:10.1073/pnas.0708818104 (2007).
4. Hsu,H. J. & Drummond-Barbosa, D. A visual screen for diet-regulated proteins inthe Drosophila ovary using GFP protein trap lines. Gene expression patterns : GEP 23-24,13-21, doi:10.1016/j.gep.2017.01.001 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470565&idx=3&sn=6df31a98c2b00e5a31165eb85ff9f27e&chksm=84e2ee91b39567872c8a115a18cbf8943c7dd94bfc942bf3b6cb396e15261bced6b4c46e1f18&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


