来源:生物通
新方法简化了对蛋白质受体复合物的研究,加速了药物的开发

利用药物治疗不正常不健康的细胞或整个器官时,它必须首先与细胞膜中的特定蛋白质受体结合。受体可以在结合过程中以多种方式改变其分子结构,只有正确的结构才能“解锁”药物的治疗效果。
要解析这个过程很难,而来自威斯康星大学密尔沃基分校和格拉斯哥大学的一个研究小组通过将药物与其独特的蛋白质受体相匹配来评估药物作用的新方法,有可能大大加速药物开发,减少临床试验期间失败的药物试验数量。
这一方法公布在Nature Methods杂志上,这减少了对候选药物“正确反应”的蛋白质受体的时间和工作量,而且减少的可是几个数量级!
“它为寻找药物靶标和药物分层开辟了一条新道路,”威斯康星大学密尔沃基分校物理学教授Valerica Raicu说,“使用这种方法,我们可以表征每种受体对各种候选药物的反应方式。”
这一方法其实就是被称为oligomerization寡聚化的化学过程,当受体作为单个亚基存在时出现,但随后在配体(药物化合物)的存在下转变为寡核苷酸,反之亦然。
“我们过去认为这些受体是二元的,”该论文的第一作者Raicu说,“它们要么被化合物激活,要么不激活。但现在我们开始明白,根据配体的不同,相同的受体可以产生许多不同的反应。”
研究人员首先使用Ionel Popa开发的融合荧光蛋白测试了该方法。然后验证了一种通常与癌症有关的生长因子受体:表皮生长因子受体(EGF)。正如预期的那样,受体的活化导致产生更大的寡核苷酸。
然后,研究小组将他们的方法应用于G蛋白偶联受体(GPCR)家族的成员,这是一组由多种药物靶向的蛋白质,验证了这种方法的有效性。
与使用现有技术的数月相比,配体和受体之间的关联在数小时内就能显示出来。
“这种表征蛋白质相互作用的新方法对于靶向同一受体的不同药物的分层非常重要,”Graeme Milligan说,“因此,这能帮助我们理解为什么有些候选药物是有效的,而有些候选药物却没有,并且可能适用于治疗许多疾病的不同类别的蛋白质。”
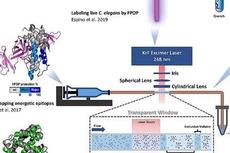
这样研究人员使用单光子或双光子激发显微镜,在不存在或存在与其结合的配体(或药物)的情况下产生各种蛋白质受体寡聚体的路线图。
研究人员通过附加荧光标签对蛋白质受体分子进行成像。单分子蛋白质受体在激光下通过时被激发发出光,并用相机记录这些过程。受体寡核苷酸发出更强烈的光爆发,并进行拍摄。
“现在你可以绘制爆发的强度和数量,”Raicu说,“看看有多少与寡核苷酸有关,找到它们在样品中的位置。添加配体后,你还可以看到它是否可以有效促进单分子受体蛋白质与寡核苷酸的结合。”
来源:gh_c1fce5726992 生物通
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675529416&idx=7&sn=35fd82ed6bd49f15210601c88a5244bc&chksm=bc51ff598b26764fca7e53a070e565164b344d0e15ca7549c4f82a36005865df8c2b456b2ec3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn