来源:BioArt
我们知道,真核生物mRNA末端有很长的poly(A)尾巴,其长度在不同物种中有些不同,从酵母中的约90个到哺乳动物中的200到250个不等。poly(A)尾功能保守,在mRNA转运、翻译和降解中起着关键作用。其功能主要由poly(A)结合蛋白(poly(A)-bindingproteins,PABP;酵母中叫Pab1,哺乳动物的叫PABPC1)介导【1】。PABP在细胞质mRNA的3’端,将它们包装成poly(A)RNP,在胞内高度动态【2】。胞质中的PABP蛋白质非常高(μM浓度),结合poly(A)RNA的能力也非常强(nM Kd),并且它能将poly(A)尾部组织成具有约27个核苷酸的重复模块。在转录物的生命周期里,poly(A)尾部会逐渐缩短,最终导致mRNA降解【1,2】。在这种背景下,PABP扮演着一个双面“间谍”的角色。一方面,它在物理上保护转录本的3’端免受非特异性的降解【3】。另一方面,它又是poly(A)尾巴脱腺苷所必须的【4】。此前,关于它是如何特异性识别目的mRNA、准确执行相应功能的分子机制尚不清楚。
2019年5月16日,Cell杂志在线发表了来自德国马普生化所Elena Conti课题组,题为Cryo-EM Structure of a Poly(A) RNPBound to the Pan2-Pan3 Deadenylase的研究长文。作者通过Cryo-EM技术解析了结合脱腺苷酶Pan2-Pan3的Poly(A)RNP分子结构,揭示了细胞质mRNA末端的周期性重复的结构基础,也在机理上阐述了RNA结合的Pab1是如何在mRNA寿命期间充当衡量poly(A)尾长度标尺的机制。

Pab1和PABPC1的N末端有四个连续的RNA识别基序(RRM)。它的N端RRM1和RRM2作为单个模块起作用,负责全长蛋白的腺苷结合特异性和亲和力【5】;同时该模块还为poly(A)结合提供了方向性,从RRM1到RRM2以3’至5’的方向识别RNA【6】。一般认为,RRM3和RRM4可能形成相似的结构模块(图1A),但它们在功能上是不同的,至少就RNA结合特性而言【5】。RRM结构域也有助于蛋白-蛋白相互作用。例如,RRM2可以结合翻译起始机制的组成部分(eIF4G)。然而,PABP的主要蛋白质结合平台位于它的C末端【7】。其C端是Mademoiselle(MLLE)结构域,识别短序列基序(称为PAM2),例如:识别翻译终止因子(eRF3)和mRNA去腺苷酸化酶(Pan3)【8】(图1A)。在RRM4和MLLE之间有一个很长的接头,介导了多个PABP分子与poly(A)的协同相互作用【9】。poly(A)RNA依赖的PABP寡聚化是poly(A)RNP形成的标志。
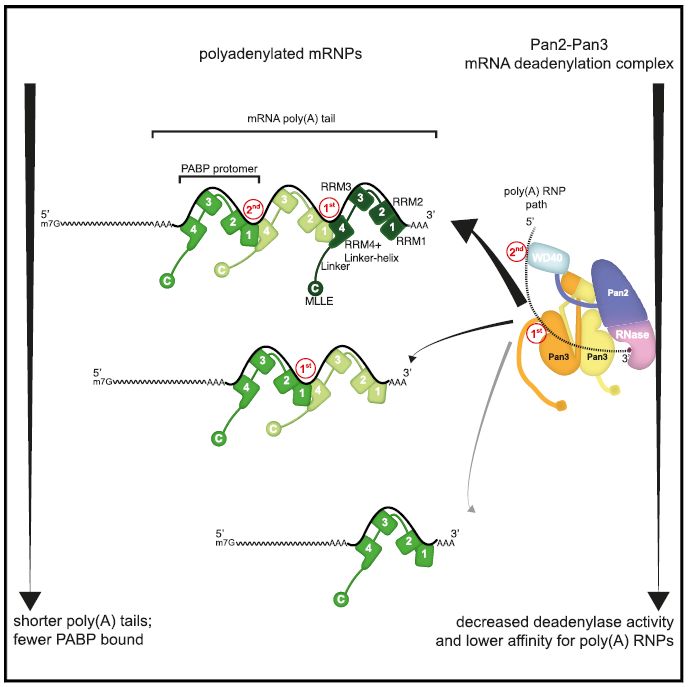
PABP在扮演双面“间谍”的角色时,在胞质与脱腺苷酶Pan2-Pan3复合物(图1A)相互作用,并且刺激Pan2-Pan3“修剪”poly(A)尾巴。另外,PABP可与负责mRNA降解的Ccr4-Not复合物相互作用,触发目的mRNA的进一步降解。遗传和生物化学研究表明,酵母和人类细胞中的脱腺苷化在不同的阶段进行【10】。在酿酒酵母中,第一阶段首先是Pan2-Pan3对3’末端进行初步修剪,直至poly(A)尾巴剩下25-40个核苷酸的临界长度。然后脱腺苷化从最初的慢速阶段转换到第二阶段。此时由Ccr4-Not会进一步将poly(A)尾巴进一步缩短,使得转录物易于脱帽,然后通过其他途径彻底降解【11】。在人细胞中的mRNA转录物降解途径也表现出至少两个阶段。但涉及Pan2-Pan3和Ccr4-Not复合物之间的转换以及它们对不同底物偏好的的分子机制是未知的。Pan2-Pan3如何特异性地识别早期poly(A)RNP,以及它在将poly(A)缩短为临界长度后又停止的原因尚不清楚。
作者通过体外蛋白重组,重建了poly(A)RNP刺激Pan2-Pan3,以催化poly(A)尾部脱腺苷的第一步过程(图1B-D)。通过Cryo-EM技术,解析了Pan2-Pan3脱腺苷酶复合物,和90A RNP-Pan2-Pan3的复合物结构(图1B-D)。
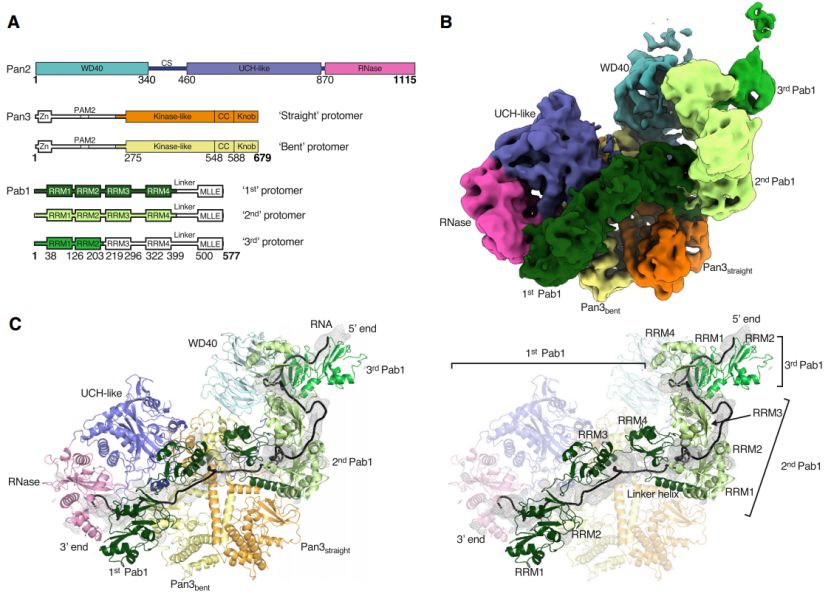
该poly(A)RNP复合物结构包含90个A的RNA、3个Pab1原体和Pan2-Pan3脱腺苷酶复合物。结构显示,单独的Pan2-Pan3复合物结构与90A RNP-Pan2-Pan3复合物中的Pan2-Pan3结构类似。在90A RNP-Pan2-Pan3复合物结构中,Pan2-Pan3与含有两个或更多个Pab1分子的poly(A)RNP结合,执行降解功能。结构揭示了Pab1的寡聚化界面是如何被去腺苷酸酶识别,并促使poly(A)RNA底物进入核酸酶活性位点的的分子机制,说明了这些结合RNA的Pab1寡聚体是如何作为poly(A)长度标尺的原因。该研究为mRNA降解的分子机制提供了重要的参考模型。
通讯作者介绍:

Elena Conti博士,1967年2月14日出生于意大利,是意大利生物化学家和分子生物学家。1991年,在帕维亚大学获得化学学士学位,1996年在伦敦帝国理工学院获得蛋白质结晶学博士学位。1997年至1999年在纽约洛克菲勒大学从事博士后研究,合作导师是John Kuriyan。1999至2006年,在德国海德堡的欧洲分子生物学实验室担任团队负责人,同时在德国Martinsried的马普所担任主任。2007年,担任德国慕尼黑Ludwig Maximilian大学的名誉教授。目前她是德国马普生物化学研究所的主任。主要研究方向是利用结构生物学和生物物理技术研究RNA转运和RNA代谢。她获得了很多荣誉,2008年,Conti因RNA转运和代谢的研究获得了德国研究人员最负盛名的奖项:Gottfried Wilhelm Leibniz奖。2014年,获得了Louis-Jeantet医学奖。2018年,她获得乌得勒支大学生物分子研究中心的Bijvoet奖章。同时,她还是欧洲分子生物学科学院(EMBO)和德国科学院院士。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470148&idx=3&sn=dfdebb0e64368eb6e8f8fa9eb3c5767b&chksm=84e2e830b3956126ec4dc7035cab1225ecaa68b5908d38c7e4178008c0d4867e16da0ec7b016&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



