来源:BioArt
原标题:邵志敏/贾立军合作团队揭示蛋白Neddylation修饰通路调控雌激素受体表达与氟维司群疗效应答新机制
乳腺癌是女性最常见的恶性肿瘤,位居癌症相关死亡原因的首位,其中60%~70%的乳腺癌为腔面型乳腺癌,雌激素受体(Estrogen Receptor,ER)表达阳性。ER是乳腺癌重要的分子生物学标志物,是乳腺癌内分泌治疗的重要靶点。内分泌治疗是ER阳性乳腺癌的标准治疗方式,可明显降低疾病的复发风险和死亡率,然而仍有将近三分之一的患者在治疗开始或治疗过程中出现疾病复发转移,即内分泌耐药。作为一类选择性雌激素受体下调剂(SERDs),氟维司群(Fulvestrant)已被批准用于局部晚期或转移性乳腺癌治疗,其显著延长患者的无进展生存期,但仍有不少ER阳性乳腺癌患者对氟维司群耐药,因此迫切需要研究新的方法克服氟维司群乳腺癌耐药。
Neddylation修饰是一类新型蛋白翻译后修饰方式。它是将类泛素分子Nedd8(Neural precursor cell expressed, developmentally downregulated 8)在Nedd8活化酶(NAE,E1)、Nedd8结合酶 (E2) 和底物特异性Nedd8连接酶 (E3) 的催化下,经过三步级联酶促反应,结合到其底物蛋白并调控底物蛋白功能。近年来,贾立军教授团队研究发现,Neddylation 修饰通路在人类肺癌【1】、脑胶质瘤【2】和食管癌【3】等中高度活化。而且,MLN4924作为Neddylation修饰通路中NAE的抑制剂,能够特异性阻断Cullin底物蛋白的Neddylation修饰,从而导致CRL连接酶功能失活,诱导DNA损伤、细胞周期阻滞、细胞凋亡或细胞衰老而发挥其抗肿瘤效应。临床前试验表明,MLN4924单药或与放化疗联合均有良好的治疗效果,目前已进入Ⅱ/Ⅲ期临床试验阶段,并显示出良好的安全性和耐受性,提示其良好的研发应用前景【4,5】。迄今为止,Neddylation 修饰通路在乳腺癌中的活化状态、其对ER表达的调控作用、以及对ER靶向药物(如氟维司群)治疗疗效应答的影响鲜见报道。
近日,复旦大学附属肿瘤医院邵志敏和上海中医药大学附属龙华医院贾立军研究团队在Clinical Cancer Research杂志上联合发表了题为Neddylation Inactivation Facilitates FOXO3a Nuclear Export to Suppress Estrogen Receptor Transcription and Improve Fulvestrant Sensitivity的论文,阐释了Neddylation修饰通路在乳腺癌中的活化状态及其与ER-α表达的相关性,进而阐明了靶向Neddylation 通路抗乳腺癌治疗下调ER-α的作用及其相关分子机制,证实Neddylation通路抑制剂MLN4924与氟维司群可以发挥协同抗癌效果。

研究人员发现:(1)Nedd8和NAE1的表达在乳腺癌组织显著高于癌旁,且与ER-α的表达呈显著正相关;(2)靶向Neddylation 通路抗乳腺癌治疗显著抑制ER-α的转录激活;(3)机制上, MLN4924抑制Neddylation 通路导致下游底物SGK1蛋白降解受阻,促进FOXO3a磷酸化以及核输出,从而减少其与ESR1启动子结合,下调ER表达;(4)明确MLN4924和氟维司群可以协同下调ER-α表达,协同增强抗肿瘤效果。
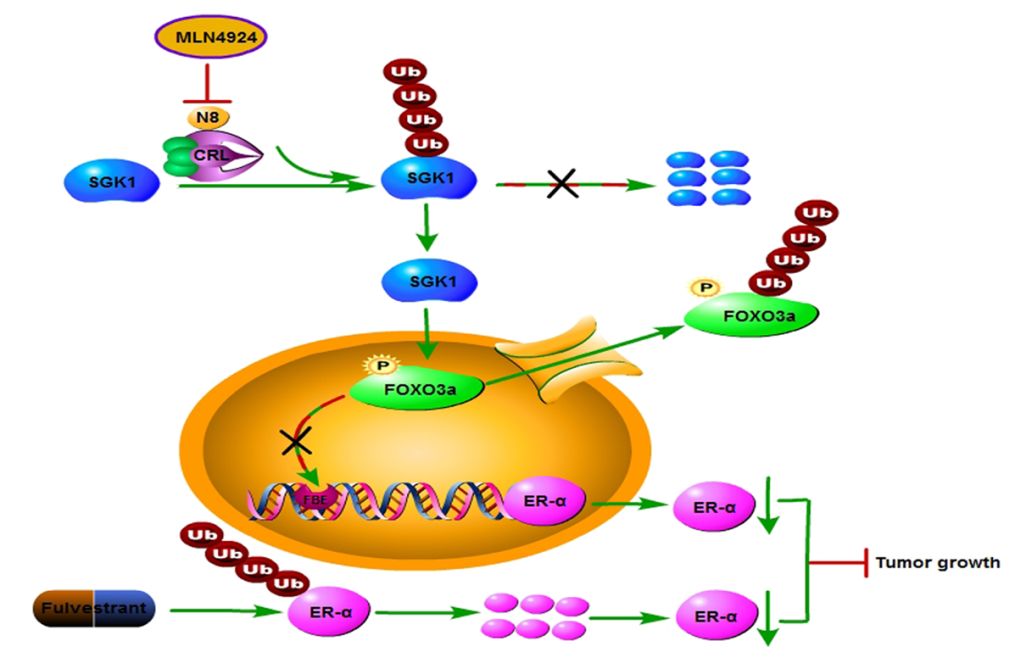
总的来说,该研究有助于更为深入、全面地解析乳腺癌内分泌耐药的分子机制,为进一步指导ER阳性乳腺癌的治疗提供了新的思路。
其中,贾晓青博士与李春杰博士为本文共同第一作者
原文链接:
http://clincancerres.aacrjournals.org/content/early/2019/04/28/1078-0432.CCR-18-2434.long
参考文献
1. Lihui li, Mingsong Wang, Guangyang Yu, et al. Over-activatedneddylationpathway as a therapeutic target in lung cancer, J Natl Cancer Inst., 2014, 106(6):dju083.
2. Wei Hua, Chunjie Li, Zixiao Yang, et al. Suppression of glioblastoma bytargeting the overactivated protein neddylation pathway, NeuroOncology, 2015,17(10): 1333- 1343.
3. Ping Chen, Tao Hu, Yupei Liang, et al. Neddylation Inhibition Activates theExtrinsic Apoptosis Pathway through ATF4-CHOP-DR5 Axis in Human EsophagealCancer Cells. Clin Cancer Research, 2016, 22(16):4145-4157.
4. Lisha Zhou, Wenjuan Zhang, Yi Sun, and Lijun Jia. Protein neddylation and its alterations in human cancers for targeted therapy.Cell Signal. 2018 Apr;44:92-102.
5. Lisha Zhou,Yanyu Jiang, Qin Luo, Lihui Li, and Lijun Jia. Neddylation: a novel modulator of the tumor microenvironment. Mol Cancer. 2019 Apr 3;18(1):77.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469802&idx=3&sn=8a2843dd6299023520f5b819c0103d18&chksm=84e2e99eb3956088fb7aaac58c156fae63dcac252ab7ca61070a8c51e9165d61025ccf5895c3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn