来源:BioArt
撰文 | 小柚
m6A是mRNA上丰度最高的修饰类型,影响了mRNA的翻译效率,稳定性,可变剪接和出核等过程,也因此在生长发育和疾病进程中扮演重要角色。并不意外地,近年来关于m6A甲基化酶(METTL3/METTL14/WTAP)和去甲基化酶(ALKBH5/FTO)在癌症中的功能不断被报道【1】。
m6A对RNA命运的决定是多样的,甚至可能是看似“矛盾”的,比如m6A促进mRNA的翻译,又促进mRNA的降解,而这个决定权则在m6A阅读蛋白“reader”手上——YTHDF1/3促进翻译,YTHDF2促进降解(图1)。但是目前对m6A的阅读蛋白识别m6A修饰的mRNA后,如何影响mRNA的功能并参与疾病,特别是癌症的进程,研究较少。

图1【1】
2019年4月25日,来自英国爱丁堡大学的Kamil R. Kranc和Donal O’Carroll教授在 Cell Stem Cell 发表Short Article: Targeting the RNA m6A Reader YTHDF2 Selectively Compromises Cancer Stem Cells in Acute Myeloid Leukemia ,该研究发现m6A阅读蛋白YTHDF2通过调控TNFR2 mRNA的稳定性参与急性髓系白血病的发生和发展。

YTHDF2是第一个被鉴定为m6A reader的蛋白,它所介导的m6A mRNA的降解过程,也是人们所了解到的m6A影响mRNA命运的第一个方面【2】。
研究者首先分析了YTHDF2在多个急性髓系白血病亚型中的表达模式,发现与正常骨髓样品相比,YTHDF2在白血病患者骨髓中的表达明显升高。这提示YTHDF2有可能促进了疾病的进程。利用小鼠模型,研究者发现,YTHDF2对白血病的发生(Initiation)和发展(Propagation)非常重要,降低YTHDF2可以显著抑制白血病进程,延长荷瘤小鼠的生存时间。更重要的是,虽然YTHDF2的缺失会导致造血干细胞的扩增(expansion),但是并没有影响造血系统的正常功能(这一点也与去年7月李凌衡教授课题组发表在Cell Research的研究 Suppression of m6A reader Ythdf2 promotes hematopoietic stem cell expansion 结果一致)。
那么,YTHDF2是如何参与白血病进程的呢?研究者发现敲低YTHDF2后,具有m6A修饰的mRNA的半衰期整体上升,说明YTHDF2在白血病中促进m6A mRNA的降解。对YTHDF2影响的RNA聚类,以及其直接结合的RNA进行分析后,研究者发现TNF介导的细胞凋亡通路在白血病中被抑制,其中TNFR2(Tnfrsf2)是YTHDF2的靶基因。YTHDF2结合并促进它的降解,从而抑制TNF信号通路 (图2) 。YTHDF2的缺失使得白血病细胞对TNF更加敏感,这有望成为提高TNF治疗效果的新策略。
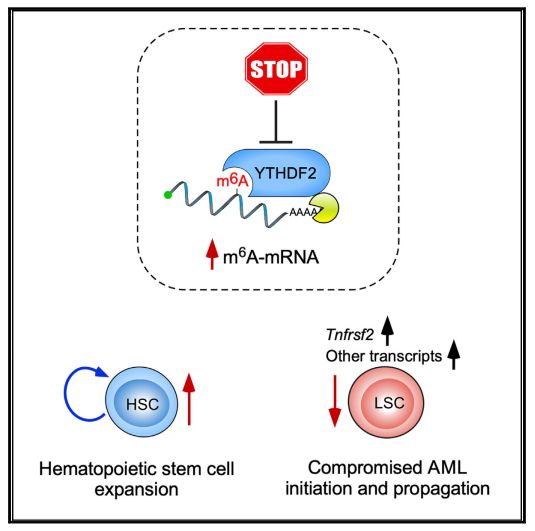
图2
值得注意的是,目前已有5项关于m6A在白血病中的功能研究【3-7】。其中,英国剑桥大学的Kouzarides T.等人【3】认为METTL3结合在基因的启动子区,使得此类基因的m6A修饰主要集中在CDS区,提高mRNA的翻译效率。何川与陈建军教授等人【4】从m6A去甲基化酶FTO入手,发现过表达FTO后,白血病细胞中大量m6A降低的mRNA丰度下降,这提示m6A提高mRNA的稳定性。那么目前已鉴定了与m6A促进mRNA翻译和提高稳定性的阅读蛋白,是否也参与了白血病的进程呢?还有待进一步的研究。
总的来说,该研究首次系统地分析了YTHDF2在急性髓系白血病中促进癌症发生发展的作用机制,有可能开启m6A阅读蛋白在癌症中作用机制研究的热潮。
原文链接:
https://doi.org/10.1016/j.stem.2019.03.021
制版人:珂
参考文献
1. Xiaolan Deng, Rui Su, Hengyou Weng, Huilin Huang, Zejuan Li and Jianjun Chen,RNA N6-methyladenosine modification in cancers: current status and perspectives, Cell Research (2018) 0:1–11;
2. Xiao Wang, Zhike Lu, Adrian Gomez, Gary C. Hon, Yanan Yue, Dali Han, Ye Fu, Marc Parisien, Qing Dai, Guifang Jia, Bing Ren, Tao Pan & Chuan He, N6-methyladenosine-dependent regulation of messenger RNA stability, Nature volume 505, pages 117–120 (02 January 2014)
3.Barbieri, I., Tzelepis, K., Pandolfini, L., Shi, J., Milla´ n-Zambrano, G., Robson,S.C., Aspris, D., Migliori, V., Bannister, A.J., Han, N., et al. (2017). Promoter bound METTL3 maintains myeloid leukaemia by m6A-dependent translation control. Nature 552, 126–131.
4. Li, Z., Weng, H., Su, R., Weng, X., Zuo, Z., Li, C., Huang, H., Nachtergaele, S.,Dong, L., Hu, C., et al. (2017). FTO plays an oncogenic role in acute myeloid leukemia as a N6-methyladenosine RNA demethylase. Cancer Cell 31, 127–141.
5. Su, R., Dong, L., Li, C., Nachtergaele, S., Wunderlich, M., Qing, Y., Deng, X., Wang, Y., Weng, X., Hu, C., et al. (2018). R-2HG Exhibits Anti-tumor Activity by Targeting FTO/m(6)A/MYC/CEBPA Signaling. Cell 172, 90–105.e23
6. Vu, L.P., Pickering, B.F., Cheng, Y., Zaccara, S., Nguyen, D., Minuesa, G.,Chou, T., Chow, A., Saletore, Y., MacKay, M., et al. (2017). The N6-methyladenosine (m6A)-forming enzyme METTL3 controls myeloid differentiation of normal hematopoietic and leukemia cells. Nat. Med. 23, 1369–1376.
7. Weng, H., Huang, H., Wu, H., Qin, X., Zhao, B.S., Dong, L., Shi, H., Skibbe, J.,Shen, C., Hu, C., et al. (2018). METTL14 inhibits hematopoietic stem/progenitor differentiation and promotes leukemogenesis via mRNA m(6)A modification. Cell Stem Cell 22, 191–205.e9
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469724&idx=4&sn=8fb81e940a3e26482c99a2214972f3ed&chksm=84e2ea68b395637edfb28f5e9d8d57446ee6dfeec8e07604dd00c9bd169fec1768a2cb887681&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



