膜蛋白在细胞代谢中起着至关重要的作用。研究膜蛋白特定区域在生物膜上的位置,尤其是沿垂直于膜方向的位置及其动态变化,对于理解膜蛋白的功能及相关的分子机制有重要意义。一些传统的生物物理技术如核磁共振(NMR)等可以给出时间和系综平均的数据,但如何实时追踪单个膜蛋白在约4纳米厚的膜内或膜表面几纳米范围内的动力学过程,仍然是一个挑战。
近期,中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理重点实验室李明研究组副研究员陆颖和博士生马东飞等,基于单个供体对多个受体的荧光共振能量转移(FRET)原理,发展了一套基于脂质体的单分子荧光检测方法(命名为LipoFRET),实现了在脂质体上单个膜蛋白动态构象和位置变化的精密观测,测量精度可达0.7纳米。LipoFRET对膜内和膜外区域的膜蛋白标记位点同样有效,是该方法独有的优势。应用此方法,他们对α-突触核蛋白(α-syn)进行了深入研究,获得了该蛋白在膜上运动的新信息,澄清了文献中一些有争议的问题。该团队此前曾发明表面诱导荧光衰减(SIFA)方法,在固态衬底表面的平面膜上记录此类信息(Nat. Comm. 7, 12906 (2017))。脂质体作为一种被广泛应用于膜蛋白研究的模型体系,拥有可调节曲率、膜流动性不受限等特性。发展在脂质体上研究膜蛋白动态过程的方法,具有天然的优势。
研究团队以单层脂质体中包裹的台盼蓝染料(TB)作为荧光受体,以膜蛋白上标记的荧光基团作为荧光供体,结合理论计算建立了膜蛋白特定位点的垂直位置与相对荧光亮度的对应关系(图1)。对单个α-syn蛋白上三个代表性位点的研究表明,α-syn的中间区域(T72)位于脂质体磷脂膜的外表面,C端的无结构尾部(S129)位于溶液中,而N端(K10)插入膜中并呈现多态的特性,其深度在各个状态之间缓慢切换(图2)。研究人员还对α-syn的C端与钙离子的相互作用进行了研究(图3)。结果显示,钙离子使部分标记在129位点的荧光基团出现了一个比原始位置更靠近膜表面的新状态,两态之间的高度差约为1.2-1.6 nm。该状态所占比例随着钙离子浓度的升高而相应增加,而相应浓度的镁离子则不会诱导α-syn的C端发生变化,清楚地揭示了钙离子对α-synC端的特异性调控作用。这一成果近期发表在《德国应用化学》(Angewandte Chemie International Edition,2019, 58,5577-5581)上。
该工作得到国家自然科学基金委(11674382, 11834018, 91753104, 11574381)、中科院前沿科学重点项目(QYZDJ-SSW-SYS014)以及中科院青年创新促进会的支持。
文章链接

图1. LipoFRET方法原理及验证。

图2. α-syn三个位点的位置及动态变化。
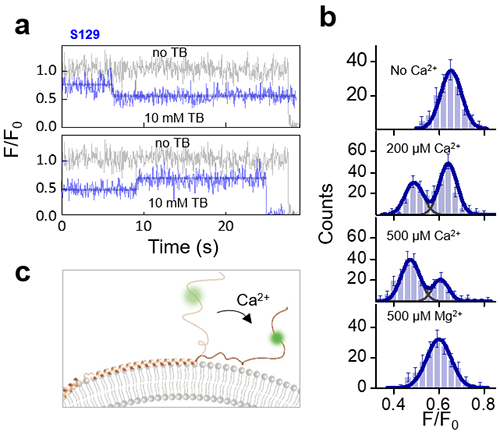
图3. 钙离子对α-syn C端的调控。
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/201905/t20190508_4691223.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



