来源:BioArt
肿瘤转移是癌症治疗的难点所在。对于高级别浆液性卵巢癌(High-grade serous carcinoma, HGSC)而言,早期的腹腔转移更是导致不良预后的首要原因。究竟是什么原因导致癌症的生长和转移?这中间的过程科学家们一直没有搞清楚,但是与肿瘤转移密切相关的成纤维细胞(cancer-associated fibroblast,CAF),一直是这个领域的研究热点之一。CAF被认为是体内产生的成纤维细胞,癌细胞可以劫持并利用它们来维持自己的生长和转移。
2019年5月2日,来自芝加哥大学的Ernst Lengyel研究团队在Nature在线发表了题为Proteomics reveals NNMT as a master metabolic regulator of cancer-associated fibroblasts的研究。他们开发了一种激光捕获显微切割(laser-capture microdissection)与高灵敏度蛋白质组学联用的分析方法,可以从石蜡包埋的组织样品中最少分析5000个左右的细胞。基于这一技术手段,他们发现N-methyltransferase(NNMT)是维持CAF细胞表型的一个重要的调控分子,并且在卵巢癌的发生发展以及转移过程中扮演重要角色。

尽管之前有多篇研究对于卵巢癌的蛋白组进行分析【1,2】,但同时对肿瘤组织(tumor)与其邻近的基质(stromal)分别进行系统性考察无疑能够更好的揭示卵巢癌的转移过程。所以,为了探究肿瘤以及肿瘤周边的基质之间蛋白表达差异,研究者搜集了11位HGSC病人组织样本,然后用显微切割技术将肿瘤组织和基质分别提取出来进行后续的蛋白质组学分析(见下图)。
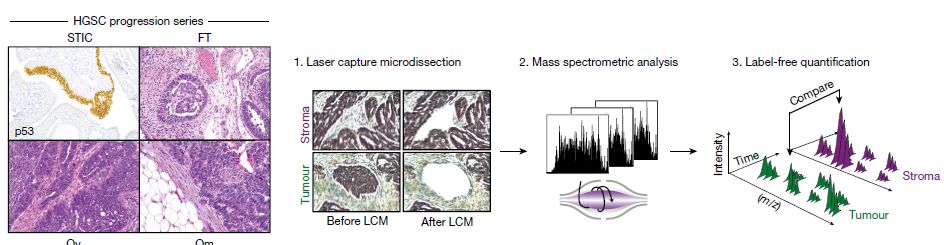
从107个样品中,作者一共鉴定到6944个蛋白。在肿瘤组织中,他们富集到几个已知的HGSC的标志物,包括PAX8,MSLN,MUC16,以及EPCAM,而在基质部分,鉴定到一些成纤维细胞激活的标志物,包括collagens, vimentin, versican, tenascins 以及 myosin。更进一步,通过原发肿瘤和转移肿瘤之间的比较,作者鉴定到唯一变化的蛋白——FABP4,一个之前已经报道在网膜转移(omental metastases)的肿瘤中是高表达的。而在对基质组分的分析中,作者一共鉴定到62个蛋白的表达量在网膜转移(omental metastases)和原发肿瘤的基质(primary stromal)中存在显著差异,其中21个蛋白表达是上调,而另外41个则是下调的。21个表达量上调的蛋白中有很多已经被报道可以促进肿瘤生长和转移,但其中一个引起了作者的兴趣,那就是可以参与表观遗传调控的NNMT。
NNMT在体内催化S-腺苷甲硫氨酸 (S-adenosyl methionine,SAM)生成S-腺苷同型半胱氨酸 (S-adenosyl homocysteine,SAH)同时将烟酰胺(nicotinamide)转化成1-甲基烟酰胺 (1-methylnicotinamide,1-MNA)。而SAM是细胞内组蛋白、DNA、RNA、脂质以及其他代谢物主要的甲基化供体,并且已有研究表明NNMT介导的SAM的移除可以通过影响组蛋白的甲基化来调控基因表达。那么NNMT是否是卵巢癌转移的“帮凶”呢?
作者首先通过免疫组化实验验证了NNMT确实是在网膜转移的肿瘤基质中是高表达的,并且在CAF细胞中敲低NNMT会使细胞形态更加趋向于正常细胞。Western结果也表明在NNMT敲低的细胞中,CAF的标志物 SMA(smooth muscle actin ),fibronectin的表达量也是显著下调的。作者进一步发现,NNMT不仅仅是胶原蛋白收缩性的必要且充分的调控分子,而且还能调控上千种基因的表达,其中包括促癌的细胞因子。基于这些发现,作者猜想NNMT可能在调控CAF细胞的表型中占据中心位置。
那么NNMT通过什么样的机制来发挥其调控作用呢?作者推测在基质中高表达的NNMT可能是通过降低SAM:SAH的比例,从而降低DNA、RNA或者组蛋白的甲基化水平,最终通过改变基因表达水平来调控CAF的表型。他们首先检测到NNMT敲低的CAF细胞中SAM:SAH的比例的确是上调的,并且DNA的甲基化水平也更高。与此同时,他们发现与转录调控相关的组蛋白甲基化位点,包括H3K4me3以及H3K27me3,其甲基化修饰水平也是显著升高的。这些结果表明NNMT的确可以通过影响甲基化水平来介导全基因组的表观和转录调控。
最后,作者在生理条件下验证了这一猜想是否正确。他们构建了一个HGSC转移的小鼠模型,然后将过表达NNMT的成纤维细胞的培养基预处理的ID8细胞(一种卵巢癌细胞)接种到小鼠体内,发现其网膜转移相比于对照组显著升高。相反,如果将NNMT敲低的CAF与HGSC细胞共同注射到小鼠体内,肿瘤细胞的增殖和肿瘤大小则显著降低,并且用NNMT的抑制剂处理也能取得类似的效果。此外,通过临床数据分析发现,基质中NNMT高表达的病人生存期更短且预后更差,而在肿瘤组织中NNMT高表达的病人却并没有显著差异。
综上,该研究团队运用了激光捕获显微切割与高灵敏度蛋白质组学联用这一新的分析方法找到了调控CAF细胞表型的关键调控蛋白——NNMT。更为重要的是,他们发现抑制NNMT的活性可以很好逆转CAF细胞的表型从而抑制卵巢癌的转移,这无疑为针对肿瘤细胞的转移过程提供了一个非常好的干预靶点,同时我们也期待新技术的革新能够为肿瘤治疗带来更多的可能性。
参考文献
1. Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature.474, 609–615(2011).
2. Zhang,H.et al.Integrated proteogenomic characterization of human high-grade serous ovarian cancer. Cell.166,755–765(2016).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469527&idx=1&sn=1787542af04234a426a0febd50a11549&chksm=84e2eaa3b39563b5795cd3aa6c5055a2504c58a39ee4058b606302c08c7bab81bc2dd1ddfb66&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



