来源:药学进展

重组人长效凝血因子Ⅶ药物研发进展
[ 摘要 ] 凝血因子Ⅶ(FVII)是一种广泛应用于治疗和预防伴发抑制物的血友病患者出血并发症的旁路制剂。诺和诺德的重组活性 FVII(rFVIIa)至今仍是全球唯一的商业化 rFVIIa 产品。因 rFVIIa 半衰期短、需多次注射,限制了其在血友病预防和治疗中的应用。总结了国内外近年来正在开发的长效 rFVIIa 药物及其研究进展,包括在聚乙二醇修饰、序列突变和融合蛋白等技术下研制的长效 rFVIIa 产品,详细介绍了各自的长效机制和药物研发进展,旨在为长效 rFVIIa 药物的研发提供参考。
正文
血友病是一种遗传性凝血功能障碍的出血性疾病,病症多为自发性或轻度外伤后出血不止,轻则造成患者终生残疾,重则短时间即可危及患者生命。血友病尚无根治办法,目前的治疗方法主要为替代疗法,通过长期输注血浆、缺失的凝血因子的方式来治疗。血友病治疗最严重的并发症是中和性抗体(抑制物)的形成,从而阻碍了替代疗法的止血作用。抑制物的产生导致血友病患者的致残率和死亡率增高,只有少数旁路制剂可用于这些患者的出血治疗,如活化凝血酶原复合物浓缩物(aPCC)和重组活性凝血因子Ⅶ(rFVIIa)。在A 型血友病中,约 30% 的重症患者和 5% ~ 10% 的非重症患者会产生抑制物,B型血友病患者有 3% ~ 5% 会产生抑制物。
活化的 rFVII 对于 A 型和 B 型血友病都具有良好的治疗效果,同时对体内产生抑制性抗体的血友病患者同样具有治疗效果,是目前临床治疗血友病的最常用药物之一。由于血液中 FVII 含量较低(0.5~ 2.0 mg·L-1,其中 FVIIa 仅占 1%),且半衰期非常短(约2.5 h),血液提取难度非常大,因此利用基因重组技术表达rFVIIa 是目前唯一可行的方法。诺其是丹麦诺和诺德(Novo Nordisk)公司在 1999 年上市的 rFVIIa,由新生仓鼠肾宿主(BHK)细胞表达。 rFVIIa 和血浆来源的 FVIIa 的结构、功能研究显示,二者仅在翻译后修饰γ 羧基化和 N 糖基化中有微小差异,但功能基本一致,均可以缩短体外凝血时间,并对无抑制物和伴发抑制物的血友病患者均具有治疗作用。诺其主要用于治疗存在Ⅷ因子(FVIII)或Ⅸ因子(FIX)中和抗体的先天性血友病和继发性血友病患者的自发性或手术性出血,在欧洲还被批准用于获得性血友病的治疗;此外,还可用于产妇分娩出血的治疗。但药物的半衰期短,约2.9 h,自发性出血标准治疗方案包括单次注射 270 μg ·kg-1,或出血后每 3 h 注射 90 μg·kg-1,共3次。
在伴发抑制物的血友病患者的大手术和严重出血治疗中,rFVIIa 的有效率达 80%~90%,已被作为药物使用了 20 多年,极少出现血栓事件或免疫原性报告。但 rFVIIa 蛋白的半衰期短,导致在急性出血或预防性治疗方案中需要频繁输注,不仅增加了患者的痛苦和不便,也增加了治疗成本,限制了其作为血友病预防治疗制剂的应用。凝血因子是治疗血友病不可替代的药物,患者需终身输注,为减轻患者负担,增加患者依从性,亟需开发长效 rFVIIa 产品。延长半衰期的长效 rFVIIa可以减少注射次数,减轻患者负担和痛苦,从而改善患者的生活质量,并使 rFVIIa 用于血友病的预防治疗成为可能。
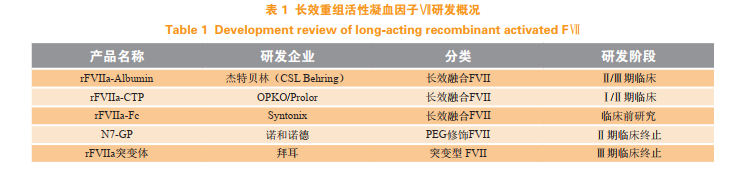
长效凝血因子近几年已成为国际上的研究热点。如长效 FIX 产品通过融合抗体 Fc 段或白蛋白等技术,成功地将注射频率从每周 2 次降低到每 10 ~ 14 d 给药1 次;长效 FVIII 产品将注射频率从每周 3 次减少到 2 次。由于 rFVIIa 的主要临床适应证是伴发抑制物的血友病,患者病例数相对较少,致使临床研究存在难度大、周期长、成本高等问题,给 rFVIIa 新药的开发增加了一定的难度,至今尚无长效 rFVIIa 产品研制成功。本文对应用聚乙二醇(PEG)修饰、序列突变和融合蛋白技术等研制的长效rFVIIa产品进行介绍,为国内 rFVIIa 药物研发提供参考和依据。国际上,包括 CSL、诺和诺德、拜耳(Bayer)等多家企业均开展了长效 rFVIIa 产品的开发工作,大部分已进入临床研究开发阶段,如表 1 所示。
1 重组活性凝血因子Ⅶ-白蛋白融合蛋白
人血清白蛋白( albumin)是血浆中含量最多的可溶性蛋白,半衰期长达 19 d,无免疫原性,组织分布广,是天然的药物载体,融合人血清白蛋白是蛋白质药物长效化改造的一种常用选择。白蛋白相对分子质量为66 500,是肾小球滤过蛋白的上限,有助于延缓肾脏的滤过作用。此外,白蛋白还以 pH 依赖的方式结合新生的 Fc 受体(FcRn),避免了溶酶体酶的降解,并进入再循环机制,从而延长了其半衰期。rFVIIa-白蛋白融合蛋白是通过 cDNA 拼接技术将FVII 与 585 个氨基酸组成的白蛋白通过甘氨酸丝氨酸柔性接头连接在一起,并在哺乳动物细胞中表达实现的 [16]。大鼠药代动力学研究表明,rFVIIa-白蛋白融合蛋白的半衰期比野生型 rFVIIa 延长了 6.7 倍,比商品化诺其延长 5.8 倍。体外和体内疗效评估结果显示,rFVIIa-白蛋白融合蛋白功能活性可与商品化 rFVIIa 相媲美。动物实验中, rFVIIa-白蛋白融合蛋白不仅半衰期和活性时间显著延长,还增强动物康复效果、降低了药物的血浆清除速率。组织分布研究显示,在大鼠膝关节处, rFVIIa-白蛋白融合蛋白维持活性的时间相比诺其延长了 10 倍,这种特征更有利于提高患者的用药依从性。杰特贝林在健康志愿者体内进行了rFVIIa-白蛋白融合蛋白的Ⅰ期临床研究。与商业化的 rFVIIa 产品相比,rFVIIa-白蛋白融合蛋白半衰期延长了约 3 ~ 4倍,约 8.5 h,药代动力学活性显著增强,同时展示出了良好的安全性和耐受性。试验中仅有 1 例轻微不良反应记录,表现为静脉注射位点疼痛和僵硬。注射后 28 d 检测期内没有检测到任何抗药抗体。目前,将rFVIIa-白蛋白融合蛋白用于 A 型或 B 型血友病患者、伴发抑制剂患者以及 FVII 缺乏症患者的临床Ⅱ /Ⅲ期研究( NCT02484638)正在进行中。
2 重组活性凝血因子Ⅶ-人绒毛膜促性腺激素β亚基羧基末端肽融合蛋白
人绒毛膜促性腺激素 β 亚基羧基末端肽(Carboxylterminal peptide of human chorionic gonadotropin, CTP)也是构建长效融合蛋白的一个常用选择。CTP 融合可以增加重组融合蛋白唾液酸含量,从而增加蛋白的黏度,遮蔽蛋白上的糖链,使其不被糖苷酶水解,保护蛋白质免受蛋白酶降解;同时可提高蛋白质糖基化程度,增加相对分子质量,因此可以获得更长的药物体内半衰期。由于 CTP 是人体自身的天然蛋白片段,免疫原性非常低,且分子构建更简单灵活,不需要插入连接序列而直接在蛋白 C 端或 N 端融合。
按照氨基酸序列推算,rFVIIa-CTP 融合蛋白相对分子质量约 54 000,但经糖基化修饰后,其相对分子质量高达 70 000。与 rFVIIa 相比,二者与组织因子(TF)的亲和力相当,但 rFVIIa-CTP 融合蛋白的特异性降低;在相似用药浓度情况下, rFVIIa-CTP融合蛋白显示了较弱的血小板结合力和较低的凝血酶生成量。将长效 rFVIIa-CTP 用于健康男性的Ⅰ期临床研究( NCT02919800)以及用于血友病患者的Ⅰ /Ⅱ期临床研究(NCT02418793)目前正在同时开展中。
3 重组活性凝血因子Ⅶ-Fc融合蛋白
免疫球蛋白 Fc 片段与血清白蛋白相似,可通过增加功能蛋白的相对分子质量降低肾小球的滤过率,同时通过 FcRn 介导的、 pH 依赖性再循环机制有效地避免蛋白降解,从而增加融合蛋白的稳定性,延长体内半衰期。Fc 融合技术已被应用于 FVIII 和 FIX 产品的开发,在临床前和临床研究中均显示了延长的凝血因子活性和半衰期。rFVIIa-Fc 融合蛋白在血友病 A 模型小鼠体内试验中,显示了与 rFVIIa 相似的凝血活性功能,且半衰期延长了 5.5 倍。
rFVIIa-Fc 融合蛋白现已经 SYNTONIX 制药公司申请国际专利(授权公开号: PCT/US2004/013940),但尚无在人体中的临床研究开发记录。国内安源生物也申请了相关专利“改良型人凝血因子 FVII-Fc 融合蛋白及其制备方法与用途”(授权公开号: CN103397009B)。
4 聚乙二醇修饰的重组活性凝血因子Ⅶ
蛋白质的 PEG 修饰也是用于延长蛋白药代动力学和提高药效的常用方法,其原理主要是通过 PEG 修饰增加分子体积,降低肾小球的滤过作用,提高水溶性等。诺和诺德开发出一种由相对分子质量为 40 000 的糖化PEG 修饰的 rFVIIa(产品代号: N7-GP),旨在预防 A型血友病或 B 型血友病伴发抑制剂患者的出血发作。PEG 修饰可延长 rFVIIa 在循环系统中的半衰期,但同时 PEG 分子产生的空间位阻阻碍了 rFVIIa 与组织因子等蛋白的结合,导致凝血功能活性下降。在临床前试验和临床试验中,N7-GP 都显示了较诺其显著延长的药物半衰期。动物实验显示, N7-GP 的循环系统半衰期(高达 25 h)是商品化 rFVIIa 的 5 ~ 6 倍;但是等物质量的蛋白的凝血活性显著降低,需要更高的药物浓度以实现止血效果 [28-29]。Ⅰ期临床试验显示, N7-GP平均半衰期为 15 h,与安慰剂组相比, N7-GP 组平均凝血酶原时间显著降低,并表现出良好的安全性和耐受性。但Ⅱ期临床研究因未显示有效的剂量效应而终止(NCT00951405)。 N7-GP 临床Ⅱ期的失败提示,仅延长 rFVIIa 的半衰期是不够的,还应在体循环中维持一段时间的高水平凝血活性。
5 蛋白序列突变的重组活性凝血因子Ⅶ
拜耳开发了一种半衰期延长、活性增加的 rFVIIa 变体 ——BAY86-6150,其通过点突变方法在 FVII 编码序列中引入氨基酸,从而增强了 rFVIIa 对激活的血小板的亲和力,并产生了 2 个额外的 N 糖基化位点 [32]。在临床前小鼠试验和体外研究中, BAY86-6150 被证明耐受性良好,显示了增强的促凝活性,相比于商品化 rFVIIa,半衰期有效延长。在早期临床试验中 BAY86-6150 也获得良好评价,临床表现出增强的蛋白稳定性,半衰期延长近 3 倍,但在Ⅱ /Ⅲ期的临床试验( NCT01625390)中,由于患者产生了可与内源性 FVIIa 交叉反应的抑制物,发生严重免疫反应而宣告终止研究。推测可能与氨基酸突变引起的蛋白分子构象的改变有关。
6 结语
血友病本身是一种罕见病,而 FVII 的主要临床适应证是伴发抑制剂的血友病,病例数相对较少,致使临床研究存在周期长、成本高等问题,给新药的开发增加了一定的难度,至今没有长效药物开发上市。
尽管一些非因子类血友病药物,如罗氏的双特异抗体 emicizumab( FIXa 和Ⅹ因子双特异抗体,商品名: Hemlibra)已被开发出来,但其价格高昂,推广存在一定的难度。 Hemlibra 用于体内产生 FVIII 抑制因子的 A 型血友病的常规预防,研究显示接受 Hemlibra预防治疗的伴发抑制剂患者年出血率低于预防性旁路治疗的患者,但使用后有些患者需要再使用含有 FIXa的旁路制剂才能更有效控制出血,临床试验中曾有 4 名患者同时使用旁路制剂发生血栓事件,尚有不清晰的缺陷需要探索。
基因治疗是目前彻底治愈血友病的唯一希望。Spark Therapeutics、 BioMarin 和 UniQure Biopharma 等多家公司都在针对血友病的基因治疗进行临床试验,且初见成效。但基因治疗也还存在一些难以避免的缺陷:患者免疫系统容易攻击修改后的细胞或肝脏细胞,导致不能分泌足够多的凝血因子,甚至发生肝细胞毒性;随着时间的推移,基因疗法效果可能会减弱;病毒载体的潜在风险等。
伴发抑制剂的血友病患者的治疗存在着明显的未被满足的临床需求,其中最重要的是需要延长药物的给药间隔,改善临床效果。目前所有研究数据显示,rFVIIa-白蛋白融合蛋白最有希望满足以上需求,有望在未来 5 ~ 10 年内成功上市,从而使伴发抑制物的血友病患者预防性治疗方案成为可能。而基因治疗方法尚存在一定的问题和争议,但在长远的未来,基因治疗技术将会随着科学的进步和技术的发展逐渐完善,有望实现其一劳永逸的治疗效果。
关于药学进展
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2019年第3期。
《药学进展》杂志是由中国药科大学和中国药学会共同主办、国家教育部主管,月刊,80页,全彩印刷。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子0.760,具有较高的影响力
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、由金融资本及知识产权相关机构百余位极具影响力的专家组成。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651305587&idx=1&sn=064d873ab9e125577ec9ded495357126&chksm=8bf4e07fbc836969b71457ce6d63fa6d82872e381304918a84cb1d7bc06c1675cf2c3775181e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

