来源:中国科学院武汉病毒研究所
近日,中国科学院武汉病毒研究所/生物安全大科学研究中心张波课题组建立了一种以甲病毒为载体的、快速高效的新型冠状病毒(SARS-CoV-2)小鼠感染模型,相关成果在线发表于国际学术期刊Cell Research(《细胞研究》)。论文题目为 “A mouse model for SARS-CoV-2 infection by exogenous delivery of hACE2 using alphavirus replicon particles”(一种由甲病毒载体递送hACE2基因的新型冠状病毒感染小鼠模型)。
SARS-CoV-2感染受体为人血管紧张素转化酶(hACE2),由于与hACE2存在关键氨基酸位点差异,小鼠ACE2(mACE2)不能介导病毒入侵,因此SARS-CoV-2不能感染普通小鼠模型。在小鼠中表达hACE2是建立SARS-CoV-2感染模型的主要方法之一。甲病毒载体具有外源基因表达效率高、安全性好、宿主范围广的特点,被广泛用于疫苗、基因治疗和细胞转导等领域。
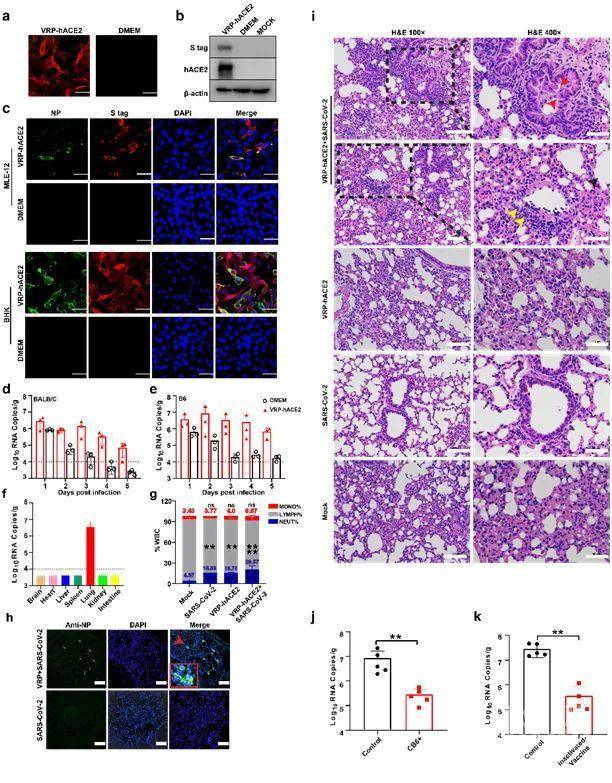
该研究以甲病毒属成员委内瑞拉马脑炎病毒(VEEV)复制子颗粒系统为载体表达hACE2受体(VEEV-VRP-hACE2)(图1 a,b)。研究首先证实了VEEV-VRP-hACE2能够使对SARS-CoV-2不易感的BHK-21和小鼠肺上皮细胞MLE-12转变为SARS-CoV-2易感细胞,在细胞水平上验证了该系统的可行性。随后小鼠体内实验结果表明提前1天对BALB/c或C57BL/6鼻腔感染VEEV-VRP-hACE2,再感染SARS-CoV-2,能够在小鼠肺部检测到病毒复制和扩增,且病毒载量连续5天保持较高水平(图1 c,d,h),小鼠肺部有明显的肺炎病症表现(图1 i),以上结果表明,VEEV-VRP-hACE2可将hACE2基因递送至小鼠呼吸道,建立一种新冠病毒小鼠感染模型。
随后,该研究团队利用此小鼠模型评价了新冠病毒的中和抗体及灭活病毒疫苗对病毒感染的治疗作用。结果显示注射中和抗体及免疫灭活病毒疫苗的小鼠攻毒后肺部病毒载量显著降低(图1 j,k),且病理损伤减轻,说明该模型能够很好地应用于中和抗体和疫苗的评价中。
该感染模型能够在普通的BALB/c或C57BL/6小鼠上快速建模,构建周期短,不需要繁殖,可实现短期内大规模推广。该模型的建立有望缓解新冠病毒研究中动物模型紧张的问题。
武汉病毒所博士生张亚南、博士后李晓丹、博士生张哲瑞为论文共同第一作者,武汉病毒所张波研究员与叶寒青副研究员为共同通讯作者。该研究得到了国家重点研发计划和国家自然科学基金的支持。
来源:WIV-CAS 中国科学院武汉病毒研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4MTA0NjQ3MA==&mid=2655195382&idx=1&sn=c1bc9f4073ba771f68cc78d3b68257ca&chksm=842d4e5fb35ac74939461045de82f12c220988d827d63540a88d85e406f7f4926fe714db7cb5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn