来源:医世象
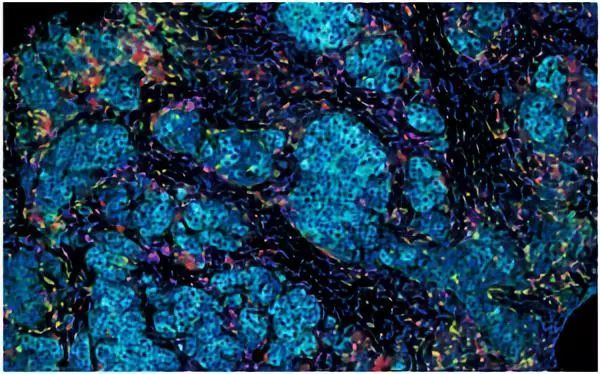
乳腺癌肿瘤周围的微环境(蓝色)中存在着不同类型的免疫细胞,比如T细胞和B细胞。
在免疫疗法时代,癌症生物学家依靠新一代工具来了解肿瘤和免疫细胞之间的相互作用是如何影响疾病进程的。
虽然Sean Bendall是一名病理学家,但最近却成了一名图谱制作者,他使用尖端的蛋白质绘图技术来描绘出肿瘤组织的变幻莫测的景观。这项技术由Bendall在加州斯坦福大学(Stanford University)的同事Michael Angelo开发。该技术能针对癌细胞及其近邻区域进行细致的分子谱绘制——最著名的应用是测绘肿瘤内外的免疫细胞。
Bendall得到的一些证据表明,这些图谱可以帮助临床医生为某些病人选择合适的治疗方案。在2018年的一项研究中,Bendall和Angelo使用他们的技术(被称为多重离子束成像(multiplexed ion beam imaging, MIBI)检测曾接受三阴性乳腺癌(triple-negative breast cancer,一种特别具有攻击性的肿瘤类型)标准化疗的病人的肿瘤标本的结构性肿瘤免疫微环境。结果,Bendall等人发现了一种能够高度预测长期无病生存的免疫微环境类型。
一个常见的误解是,肿瘤组织由两种细胞组成,即由异常或健康的细胞组成。但现实远比这个复杂:癌细胞与免疫细胞、血管和支持结缔组织广泛相互作用。这种肿瘤的“微环境”可以深刻地影响疾病的特征和患者对治疗,特别是免疫疗法的反应,免疫疗法是一种可以提高机体免疫系统对肿瘤杀伤作用的治疗方法。例如,微环境可以决定附近的免疫细胞是否“开启”或“关闭”,或者甚至是否能够接近肿瘤。正如纽约纪念斯隆-凯特琳癌症中心(Memorial Sloan-Kettering Cancer Center)的计算生物学家Dana Pe'er所说, 肿瘤不仅仅是一堆同质细胞,它实际上是一个器官——一种严重畸形的器官。
利用MIBI之类的肿瘤绘图技术,以及基于基因表达或蛋白质含量对大量单个细胞进行详细普查的其它方法,研究人员现在正在剖析肿瘤微环境的结构和功能。这些工具是如此新颖,以致许多研究人员仍然在摸索如何能最佳地利用这些工具。但由此产生的见解可能有助于开创一个新的肿瘤剖析时代——一个通过深度分析肿瘤微环境,收集例如其中存在的免疫细胞的数量和类型之类的信息,而不是专注于个体遗传变异,最终得到细胞生态系统的“全局”视图的时代。
纽约市西奈山伊坎医学院(Icahn School of Medicine)的肿瘤内科医生Miriam Merad表示,这些功能确实会对癌症治疗产生影响。
细胞普查
肿瘤和免疫系统之间的相互作用可能会影响人类疾病,这个观点并不新鲜——50年来,免疫学家Wolf Fridman基于对白血病中名为T细胞的免疫细胞反应的早期观察,一直在研究这种相互作用。Fridman指出,很快他就确信免疫反应的位置和组织非常重要。Fridman现在是巴黎笛卡尔医学院(Medical School Paris Descartes)的名誉教授。然而,直到大约十年前,随着强大的免疫治疗策略的出现,这些相互作用的广泛影响才成为肿瘤学家的主要焦点。
病理学家可以用苏木精和伊红(haematoxylin and eosin, H&E)染色和免疫组织化学(immunohistochemistry, IHC)等常规技术获得肿瘤免疫细胞组成的信息。IHC使用识别组织标本中特定分子特征的酶标记抗体,已被证明能为检查点抑制剂类药物的使用提供重要指导信息。免疫检查点治疗剂的作用机制是阻断那些抑制局部免疫细胞攻击肿瘤的特异性信号传导蛋白,而IHC可以揭示这些蛋白质的存在。
Bendall提醒,如果患者肺部肿瘤中检查点蛋白质表达很低,那么使用检查点抑制剂就基本不会有效果。然而,许多表达这些蛋白质的患者对检查点抑制剂也没有响应,研究人员正在寻找可能更清楚地预测治疗是否有效的其它疫特征。但IHC并不是发现这些特征的最佳策略,因为它一次只能分析少数分子标记。

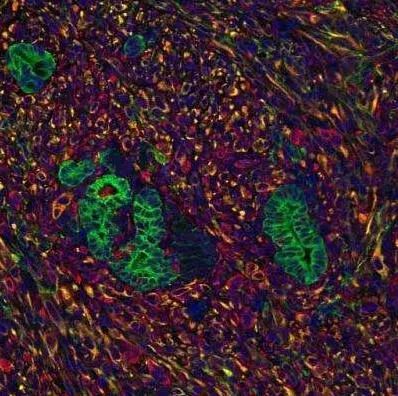
MIBI得到的肿瘤和免疫细胞的分子谱。
细胞被染上色,以显示其距肿瘤边界的距离(左)或遗传标记的表达(右)。
飞行时间质谱流式细胞术(Mass cytometry by time-of-flight, CyTOF)可以对更多的肿瘤细胞进行分析。常规流式细胞术将抗体偶联到染料或荧光标记上,而CyTOF使用与金属同位素连接的抗体来标记来自肿瘤样本的大量细胞。质谱仪能够非常快速地分析这些同位素标签,并行地为每个细胞检测和量化数十种不同的标记物。
2017年,Merad等人将CyTOF应用于肺腺癌(lung adenocarcinoma)——一种最常见的肺癌形式,并使用多达40种不同的标签抗体来标记细胞。他们的数据揭示了新出现的肿瘤如何通过招募免疫抑制调节性T细胞,并阻止包括杀死肿瘤的自然杀伤细胞在内的“效应细胞”的迁移来迅速抑制病人的免疫反应。Merad指出,即使在肿瘤开始变得恶性的早期阶段,肿瘤细胞都会想办法抑制这些效应细胞。这些结果表明,在肿瘤发展的早期逆转免疫抑制可能会阻止肿瘤进展,并有望阻止转移。
分析转录物
CyTOF需要事先了解细胞类型特异性标记,以便研究人员选择合适的抗体。Peer指出,CyTOF的一个局限性是,几乎没有提供有关生物功能的直接信息,只提示细胞标记的存在与否。
诸如RNA测序(RNA sequencing, RNA-seq)的转录组分析技术可以提示一些功能方面的信息。RNA-seq采用高通量测序平台来表征和定量大量蛋白质编码信使RNA转录本。这提供了一个直接的窗口,可用于观测哪些基因在给定的细胞中被关闭和打开,从而揭示肿瘤中发生的生物活动。十多年来,研究人员一直在应用这些技术,但其中大部分都是“大量”分析——一次性分析肿瘤中的每个细胞。马萨诸塞州剑桥市博德研究所(Broad Institute)的计算生物学家Aviv Regev指出,虽然这种方法可以提供有用的见解,但也可掩盖了细胞之间的差异。
Regev的实验室开发了一种名为Drop-seq的方法,该方法将单个细胞封装在单个脂滴中,经预处理后便可进行测序。在此过程中,每个细胞的RNA都会有一个不同的遗传条形码,从而直接确定哪些转录物来自同一细胞。Regev表示,他们得到的结果非常全面——丰富的细胞类型,以及丰富的分子种类。至关重要的是,和其它单细胞RNA-seq方法不同,Drop-seq不需要事先知道感兴趣的基因、基因表达谱,以及可以用于重建细胞之间的相互作用。Regev去年针对黑素瘤肿瘤的研究中证实了Drop-seq技术的这种独特优势。Regev等人发现恶性细胞实际上可以呈现一种特定的状态,它们形成所谓的‘冷的生态位’(cold niches),那里没有T细胞。可想而知,这样的肿瘤区域对免疫疗法更具抗性。
单细胞RNA-seq(scRNA-seq)的实施相对简单,目前有几种商业仪器可供使用。但该技术仍然存在一些重要挑战。也许最重要的是肿瘤标本必须直接从手术室运输到实验室,中间的流转时间必须短。Merad指出,单细胞方法仅对新鲜细胞提供信息,因为当我们冷冻和解冻细胞时RNA很快就会降解。
然而,该技术可以揭示其它方法无法揭示的细胞类型和细胞状态,并揭示免疫细胞功能的细微差别,传统用于分类细胞的简单类别完全不足以涵盖这些细微差别。Pe'er表示,免疫细胞之间的差异和子类型远比我们想的要多,我们过去常喜欢根据细胞是促癌还是抑癌,将其分类为好的和坏的,但系统要复杂得多,大多数细胞既有好的一面,又有坏的一面。
各种技术的利与弊
尽管CyTOF和RNA-seq功能强大,但是还需要进行严格的权衡,因为它们需要破坏肿瘤组织才能得到单个细胞。破坏组织意味着丢失空间细节,而这些细节对于理解恶性细胞与其微环境之间的相互作用非常重要。诸如IHC和H&E染色之类的方法捕获了这些空间细节,但是单个实验只能揭示有限的信息,无法得到整个微环境的全局视图。Bendall指出,他曾看到过他们部门的病理学家把幻灯片放在一起,一张张看,从而观察多个特征。2014年开发的两种成像技术可以提供丰富的空间数据,而无需把多张图片堆在一起整理数据。
第一种成像技术是质谱流式细胞成像术(imaging mass cytometry, IMC),由瑞士苏黎世大学(University of Zurich)的Bernd Bodenmiller等人开发。与常规CyTOF一样,IMC样品采用金属同位素标记的抗体,但在Bodenmiller的技术中,抗体标记在完整组织上,而不是解离的细胞上。然后用激光扫描样本,破坏组织并释放同位素标记,再用CyTOF分析。这使得研究人员能够在完整样品上以亚细胞分辨率同时测量数十种标记物,其细节水平大大超过IHC。Bodenmiller表示,IMC能分析的细胞/分子数量比IHC多几个数量级,这为免疫标记物的分析带来了更多的定量信息。
第二种技术是Angelo和Bendall在斯坦福大学(Stanford University)的免疫学家Garry Nolan的实验室工作时开发的MIBI。MIBI同样使用同位素标记的抗体标记样本,然后用扫描离子束从样本中释放出这些标记,但MIBI使用不同类型的质谱仪进行同位素分析。Angelo和Bendall继续完善这一平台,以提高其速度和易用性,正如他们在2018年针对三阴性乳腺癌的研究所强调的那样。Bendall指出,过去常常需要花费近一天来获取一张小图片,但他们最终在大约一周半内对大约40名患者的样本进行了分析,并分别获取了毫米大小的方形图像。
虽然这两种技术仅用于少数已发表的研究,但MIBI和IMC已经证明了获取细胞在肿瘤微环境中的空间位置相关信息的价值。Bodenmiller指出,大家都说肿瘤是高度异质和随机的系统,但他们发现很多结构和细胞间的相互作用并不是随机的。
Merad警告称,IMC和MIBI现已上市,但学习这两种技术并不简单。这些基于质谱的系统容易受到很多因素的干扰,她认为现场需要一名工程师来保护设备免受移动和光线等环境因素的影响。虽然可以获得越来越多的同位素标记抗体,但开发和优化新探针可能是一个艰苦的过程。Bodenmiller也指出,这些基于质谱的方法可能不如IHC的荧光变体灵敏,后者通常使用信号放大策略,即使是非常稀缺的蛋白质也能被可视化。
瑞典皇家理工学院(KTH Royal Institute of Technology)的基因组学研究员Joakim Lundeberg和斯德哥尔摩卡罗林斯卡医学院(Karolinska Institute)的干细胞生物学家Jonas Frisén设计了一种更简单,但分辨率更低的替代技术。他们开发的空间转录组学方法需要将肿瘤标本直接放置在排列有数千个寡核苷酸的载玻片上,使得样品的每个区域对应于不同的序列条形码。然后使组织可渗透,使其mRNA扩散出来并被固定的寡核苷酸捕获。接着,剩余的组织被清理掉,使用测序仪对载波片上的RNA进行测序,相关的条形码便能显示每个转录物在原组织中的位置。
这种空间转录组学方法缺乏单细胞细节,但它捕获了在蛋白质水平难以获得的信息,特别是对于稀缺或分泌到细胞外空间的蛋白质。在去年发布在bioRxiv预印本服务器上的一篇论文中,Lundeberg的团队使用这种方法来描述乳腺肿瘤中的免疫细胞活性。他指出,他们可以在一次活检中看到,在肿瘤的一部分有免疫细胞浸润肿瘤,而在同一肿瘤的另一端,免疫细胞仅在肿瘤外围分布,而不渗入肿瘤。
新型诊断方法这些方法的临床效用已得到了初步证实。2017年Bodenmiller和Pe'er之间的合作表明,某些免疫谱可以为患有某种形式的肾癌患者提供预后。Bodenmiller等人基于数据,得出了一个方程式,他们可以用它来计算这些患者的无进展生存期。同样,Merad和Regev利用肿瘤微环境调查的见解来确定可能克服肺癌、乳腺癌和其它癌症中的耐药性和免疫抑制问题的治疗疗程,目前这些治疗课程的临床试验正在准备中。然而,构建用于全面微环境分析的实验和分析管道可能给临床设施带来沉重负担。Merad的部门组建了一个由外科医生、病理学家、技术专家和癌症生物学家组成的紧密集成的团队,以及数百万美元的尖端器械库,其中包括三台CyTOF机器、三台单细胞RNA-seq仪器和一个MIBI平台。她表示,这项技术非常昂贵,且属于劳动密集型,而且他们还有许多东西仍处优化阶段。她从未如此兴奋,但也从来没有那么累。对于许多癌症中心来说,这样的投资是遥不可及的,但这些开创性设施的研究结果很快就会渗透到更广泛的社区,揭示能用较便宜的技术进行检测的生物标志物和疾病概况。诸如人类细胞图谱(Human Cell Atlas)之类的国际合作项目正在整合可公开获取的“指南”,以指导基于基因组学、转录组学和蛋白质组学的数据对细胞,尤其是肿瘤微环境中的细胞来进行分类。作为“泛癌症图谱”(Pan-Cancer Atlas)计划的一部分,包括华盛顿州西雅图系统生物学研究所(Institute for Systems Biology in Seattle)的计算生物学家Ilya Shmulevich在内的研究人员已经分析了超过1万个肿瘤标本的免疫和肿瘤细胞组成。Shmulevich指出,这些数据已经存放在癌症研究所(Cancer Research Institute)的iAtlas库(一个免费提供的数字资源,临床研究人员可能有一天会用它来对自己的样本进行分类)中。重要的是,即使在不同的肿瘤类型中,微环境似乎也存在相当大的共性。作为Pan-Cancer Atlas工作的一部分,Shmulevich等人根据肿瘤的免疫状态,将代表33种不同癌症类型的各种肿瘤分为6类。反过来,这些亚型反映了人体免疫系统对肿瘤的反应,因此可能可以预测免疫疗法的成功程度。Shmulevich的团队与纽约州立大学石溪分校(Stony Brook University)的计算生物学家Joel Saltz合作,随后发现,可以使用机器学习分析传统H&E染色的结果,从而识别免疫细胞组织模式。他表示,你可以看到各种细胞的空间信息,以及T细胞的聚集状态,或者它们与肿瘤边缘的接近程度,这些信息现在能提供诊断信息,甚至可能提供预后信息,还可预测患者对治疗的反应。Pe'er现在希望技术发展的脚步能放缓,从而让更多的科学家能迎头赶上。她表示,她们刚开发了一堆新工具,现在她们需要开发更多的计算方法,从更多的队列中收集更多的患者数据,以了解这些工具能告诉人们哪些信息。原文检索:Michael Eisenstein. (2019) Cellular censuses to guide cancer care. Nature, 567: 555-557.
来源:medhealife 医世象
原文链接:http://mp.weixin.qq.com/s?__biz=MzU4NjUyNzYyOQ==&mid=2247491385&idx=2&sn=2756a5405377d63a85dcbdef1cddb34c&chksm=fdf8b9dbca8f30cd390daa4760ff3d3adaf9500163f742d9134212cb1a341367ed6ce00a68b1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



