来源:植物科学最前沿
细菌CRISPR-CAS9基因编辑系统可以通过对病毒基因组的直接剪切来提供宿主对DNA病毒的抗性。与使用CRISPR/CAS9进行常规基因编辑不同,利用Cas9系统对病毒进行干扰需要在宿主中持续永久性地表达核糖核蛋白复合体,该系统已成功被用于设计针对哺乳动物细胞系中潜伏的HIV-1病毒、乙型肝炎病毒、单纯疱疹病毒和人乳头瘤病毒的免疫。但CRISPR/CAS9病毒干扰系统对于靶标病毒在进化的影响程度还不清楚。
2018年4月29日,瑞士苏黎世理工大学分子植物研究所Hervé Vanderschuren课题组在Genome Biology发表了题为”Linking CRISPR-Cas9 interference in cassava to the evolution ofediting-resistant geminiviruses”的研究论文,研究结果发现,大约有33%~48%的被编辑的病毒在靶标识别位点进化出了一个保守的单核苷酸突变,从而避免了被宿主植物中CRISPR/Cas9系统切割。

研究人员首先选取了双生病毒中AC2和AC3作为靶标基因,获得了携带CRISPR/Cas9编辑系统的转基因木薯。然而抗性调查显示,转基因植物和对照对于双生病毒的抗性没有展现出明显的差异。
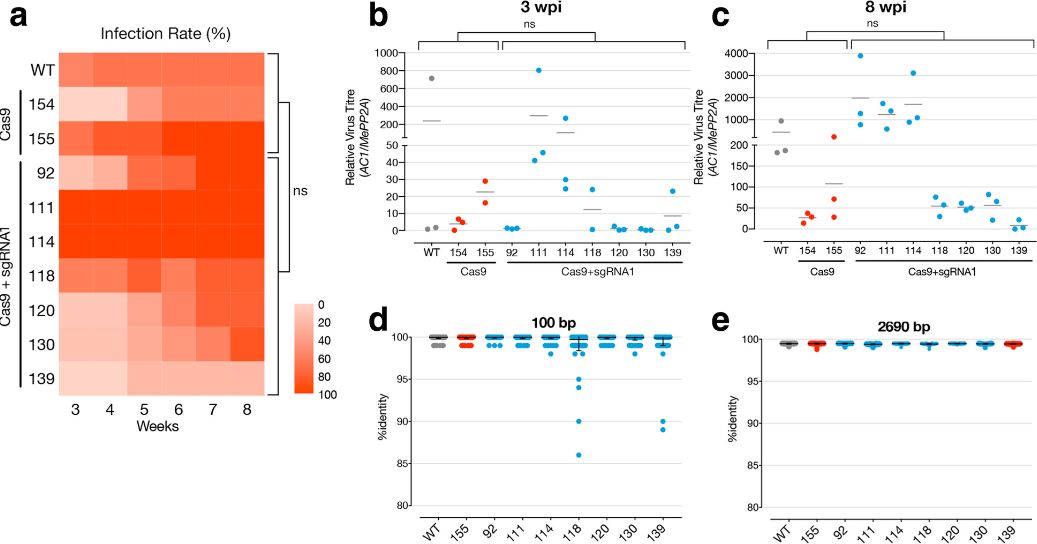
图1 携带CRISPR/Cas9转基因木薯对双生病毒的抗性
为了更好的理解这种现象的存在,研究者对侵染后3周和8周的样本进行单分子实施测序,并对整个病毒基因组进行序列分析,以检测目标病毒序列的编辑情况。在对AC2基因靶位点进行分析时,靶标序列位置上一个单核苷酸(T)的插入突变引起了研究者的注意,进一步的研究显示,该突变在三个独立的转基因系的样品中存在,而在对照系样品中没有检测到,作者将该病毒突变体命名为ACMV-AC2H54Q。由于该核苷酸的插入导致了AC2基因的提前终止,然而,这种突变也产生了一种新的ORF。
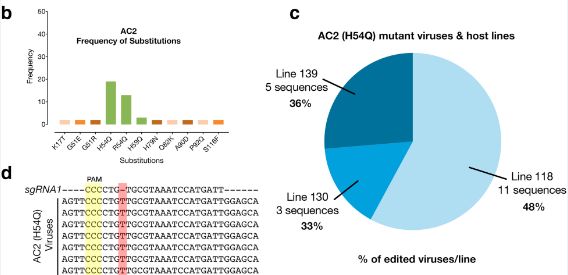
图2 对转基因木薯中基因编辑的病毒深度测序分析
由于该突变发生于sgRNA序列中,这就意味着这种突变体是在抵抗AC2基因被剪切的过程中受到了选择,从而达到防止AC2被进一步剪切的作用。
对模式植物N.benthamiana的后续实验表明,转基因中检测到的突变病毒的复制依赖于野生型病毒的存在。这一观察表明突变病毒需要野生型病毒表达的AC2和AC3蛋白。在N.benthamiana中,突变病毒的积累程度也比转基因木薯中低得多,这可以解释为野生的N.benthamiana不能选择具有编辑抗性的病毒。
总结:该研究中CRISPR-CAS9转基因植物未能表现出有效的双生病毒抗性,同时发现使用CRISPR-CAS9导致了一种新的保守突变病毒的出现,这种病毒不能被CRISPR-CAS9切割。作者提醒应当谨慎地在温室和野外环境中应用CRISPR-CAS9进行植物抗病毒育种,以避免诱导抗性病毒的进化。
来源:frontiersin 植物科学最前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyOTY2NDYyNQ==&mid=2247491716&idx=3&sn=c6ff85cff959e250dc421b2c68cc5d6f&chksm=e8bd929adfca1b8c8c79fe9d9d6e71e2cdaac6a04ba191cfb41ae8224e9783751baac2a14796&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



