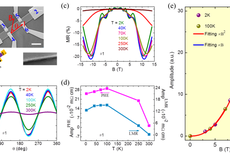
来源:上海交通大学
上海交通大学冯传良研究团队与北京大学口腔医院邓旭亮、卫彦研究团队在三维手性微环境调控干细胞命运方面有重大进展。相关研究成果以“Chirality Controls Mesenchymal Stem Cell Lineage Diversification through Mechanoresponses”(手性特征通过细胞的机械感受调控间充质干细胞的分化)为题,于2019年3月5日在线发表在国际权威期刊Advanced Material(《先进材料》)。
从仿生和组织修复需求的角度设计与构建高生物活性支架材料,实现细胞组织功能的选择性调控,促进骨组织修复重建成为口腔医学重要发展方向。在这一过程中,干细胞响应支架材料微环境特征引发功能分化差异的分子机制是科学问题的核心,是设计与构建具有“生物响应调控”功能的支架材料的理论基础与依据。生命体是长期自然进化的结果,是一个典型的多级多层次手性体系。作为生命体的基本构成单元,天然生物分子通常都是手性分子,高度的手性选择性是其执行生物学功能的前提。在生命发生过程中,这些手性分子自组装形成具有特殊立体构象和功能的生物结构,并进一步装配形成具有三维手性结构的细胞器、细胞外基质,从而形成组织和器官等更高级的生命体的宏观非对称性形态,行使相应功能。因此,手性选择的过程与规律不仅是生命起源的重大科学问题,也是再生医学支架材料活性功能设计的重要基础。
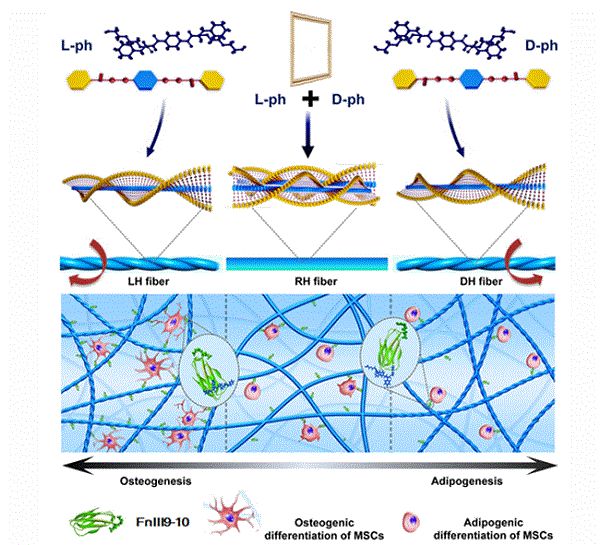
通过两个团队之间合作,利用苯丙氨酸的分子手性和自组装特性,深入研究了其组成的三维手性微环境如何调控干细胞命运(如图),研究发现纳米纤维的左右旋超微手性组装可以有效调控粘附分子Fn 空间构象,引发整合素Itgα5β1 识别分子动力学差异,进而启动FAK-ERK-pERK 与YAP/RUNX2 力学信号传导,诱导BMSCs 成骨与成脂分化差异,揭示出超微手性结构是调控分子识别动力学、启动细胞微纳力学响应的关键特性。这一发现不仅为理解生命起源中手性选择的过程与规律奠定了理论基础,也为设计与构建具有“生物响应调控”功能的支架材料提供重要启示。
北京大学口腔医院邓旭亮与上海交通大学冯传良教授为共同通讯作者。该项工作得到国家自然科学基金(81425007, 31570990, 51833006, 51772006, 31670993, and 21425314)资助。
来源:Polymer-science 高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651717608&idx=2&sn=75331368d79cb2762e27f3354bbf6a49&chksm=8b49edadbc3e64bb6e4756fb4831f2daed49de1b610a7be4f4fd07b791dec5c7549f2adb589f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn