小G(small GTPases)蛋白作为信号转导中重要的分子开关,与许多不同的调控因子和效应器分子相互作用,产生细胞功能的多样性。在人类中,目前共发现超过150个家族成员。在果蝇、秀丽隐杆线虫、酿酒酵母、粟酒裂殖酵母和植物中也都发现了家族中保守的同源物。Ras癌基因蛋白是该家族的创始成员,基于序列和功能相似性的分析,主要分为六个分支:Ras,Rho,Rab,Ran,Arf和RJL。小G蛋白具有共同的生化机制,主要是作为分子二元分子开关发挥生物学功能。虽然在生化功能上与异源三聚体G蛋白的α亚基相似,但Ras家族蛋白主要作为单体小G蛋白发挥生物学功能。其中结构的变化,决定特定亚细胞定位的翻译后修饰等使得这些小G蛋白能够在非常复杂和多样化的细胞过程中发挥重要的调节功能。
RJL家族于2004年首次被定义为一组独立的Ras相关小G蛋白家族成员。与通常表现出多样且复杂基因组结构的其他Ras家族成员相比,RJL家族通常每个基因组仅呈现一个代表性的同源物。尽管基因组内多样性如此之低,但RJL成员仍然可以清楚地分为两个不同的亚家族:Rj1和Rbj。与Ras超家族其他成员明显的不同点是Rbj天然不具有水解GTP的能力,这导致其一直处于GTP激活状态。同时还发现其C端包含DnaJ结构域,这与家族中的其他成员完全不同,并且研究发现Rbj也在一些癌症发生的通路中发挥了重要的作用。因此对Rbj结构的解析不仅可以更好地理解Rbj天然处于不能水解GTP的原因以及DnaJ结构域对Rbj的调节功能,同时也可以根据结构信息来设计相应的药物靶点。
4月4日出版的Protein & Cell 杂志报道了中国科学院苏州生物医学工程技术研究所研究员高山团队联合中国科学院昆明动物研究所研究员赖仞团队合作的研究论文“Crystal structure and function of Rbj: A constitutively GTP-bound small G protein with an extra DnaJ domain”。该工作解析了小G蛋白家族成员Rbj的晶体结构,这是家族中第一个包含典型的GTP结合结构域和额外的DnaJ结构域的结构。同时结合体外的功能实验,系统阐述了导致Rbj天然不具有水解GTP的能力的关键位点。
研究团队发现Rbj中G-domain和DnaJ domain是两个独立的结构域,它们之间通过一段柔性区域相结合,从而为这两个结构域独立与效应蛋白的结合提供了足够的灵活性。虽然Rbj具有Ras超家族中非常保守的G-domain,但是其并不具有水解GTP的能力,因此在解析的结构中可以看到活性口袋中包含有GTP小分子。通过序列比对以及体外的酶活性和稳定性实验,共鉴定到6个对Rbj活性影响最关键的氨基酸,分别是位于P-loop区的Ala25和Glu26; Switch Ⅰ区的Tyr45以及Switch Ⅱ区的His75、Pro76和Phe77。同时Rbj与Hsp70的结合模式,也为DnaJ结构域与效应蛋白之间的结合提供了一种可能的作用机制。该研究也为后续与Rbj相关信号通路药物的设计提供了重要的分子基础。
文章链接

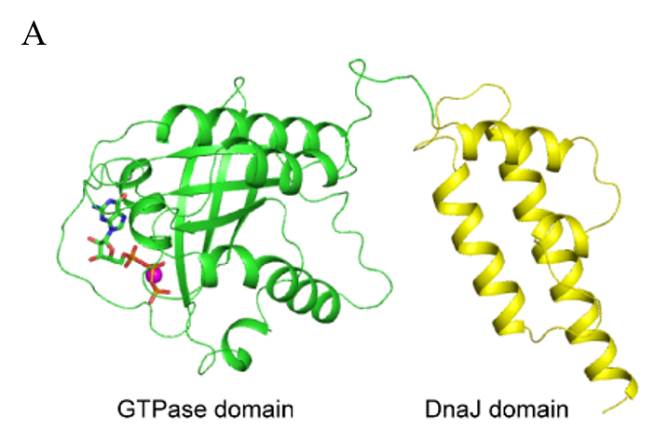
图:Rbj的晶体结构和对活性位点关键氨基酸的酶活分析
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/201904/t20190416_4689003.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn