来源:iNature
原标题:Mol Cell | 华人团队开发新型基因编辑系统,高效实现基因大片段敲除,为攻克病毒性疾病带来新希望
CRISPR/Cas系统是细菌和古菌中独有,而且广泛存在的一种免疫防御系统,通过对核酸的切割作用来抵御病毒和外源核酸的入侵。该系统于2012年被解析,并于2013年由张锋等人首次用于哺乳动物系统的基因组编辑。此后CRISPR/Cas基因编辑系统的到了迅速发展和应用。
截止到目前,成功应用于真核系统基因编辑的Cas9、Cas12以及Cas13均属于Ⅱ型CRISPR/Cas,Ⅱ型只需要单一蛋白酶执行核酸的切割,相对简单易用。然而,Ⅰ型CRISPR/Cas在细菌和古菌中的分布更为广泛,占比超过90%,但目前还没有Ⅰ型CRISPR/Cas系统成功进行真核细胞的基因编辑。
2019年4月8日,Cell 子刊 Molecular Cell 杂志在线发表了题为:Introducing a spectrum of long-range genomic deletions in human embryonic stem cells using Type Ⅰ CRISPR-Cas 的研究论文。
该研究表发现CRISPR/Cas3可以在人胚胎干细胞中实现大片段的基因敲除(几百bp-100kbp),编辑效率高达13%-60%。这是Ⅰ型CRISPR/Cas系统首次在真和系统实现基因编辑,这一发现表明Ⅰ型CRISPR/Cas系统在真核系统中有巨大的基因编辑潜力和应用价值。
CRISPR/Cas3可以有效的从人类基因组目标位点进行大片段敲除,效率远超传统的CRISPR/Cas9系统。Cas3的这一能力对于清除单纯疱疹病毒、EB病毒、乙肝病毒这些异位整合的顽固病毒,带来了巨大希望。
通讯作者:张燕(密歇根大学)、柯爱龙(康奈尔大学)

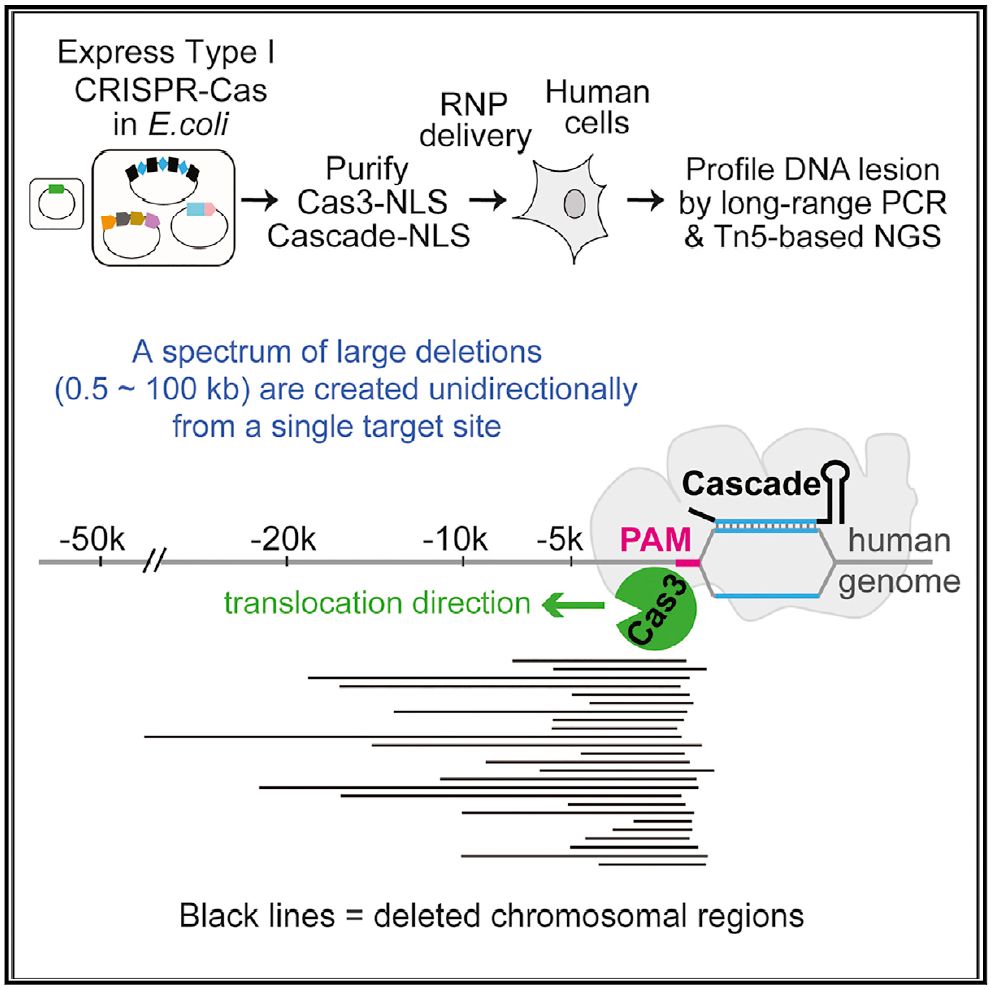
对于目前研究的最成熟、应用最广泛的CRISPR/Cas9系统来说,Cas9系统使用sgRNA来识别目标DNA序列,识别匹配后,sgRNA将Cas9蛋白精确引导到目的DNA序列,然后Cas9蛋白就会在正确的位置切割目标DNA。CRISPR/Cas3使用相同的机制来定位目标DNA序列,然而,Cas3不是仅仅将DNA双链一切为二,而实会连续消除DNA片段,最多可长达100K碱基对。
该研究在人类胚胎干细胞和HAP1细胞中,使用该系统成功敲除了长达100Kbp的DNA超长片段。
超过98%的人类基因组是非编码序列,这些非编码含有对基因调控和疾病很重要的顺式作用元件。然而,这些大片段的非编码序列,目前还没有得到很好的表征。之前通常使用一对sgRNA引导的CRISPR/Cas9来实现对大片段基因组的敲除。这种方法费时费力,而且效率比较低。
这项研究表明,CRISPR/Cas3可用于有效筛选非编码遗传元件并实现大片段的基因敲除。一旦成功被敲除,就能够通过检查生物体或细胞中缺少哪些功能,从而确定该DNA片段的作用。
这种Ⅰ型CRISPR/Cas能够从单个靶向位点产生多样的大片段DNA缺失,使得针对大片段DNA功能的CRISPR筛选更简单且更具成本效益,因为所需的sgRNA更少,而且每个sgRNA都会导致一个片段缺失突变体库。
单纯疱疹病毒、EB病毒、乙肝病毒,它们在全世界范围内感染了数以亿计的人,除了疫苗预防,并没有很好根治方法。CRISPR/Cas3具有的长片段DNA敲除能力,能够很好的定位和清除这些病毒基因组,从理论上来说,CRISPR/Cas3为根治这些病毒性疾病提供了有前景的治疗手段。
CRISPR/Cas3具有比CRISPR/Cas9对基因组更大的影响范围,但研究人员正在努力控制Cas3对DNA敲除的长度。目前还无法准确定义其敲除边界,这对于治疗来说是一个必须要解决的缺点。
总的来说,该研究首次将Ⅰ型CRISPR/Cas系统成功引入真核基因编辑,极大地扩展基因组工程工具包。Cas3的大片段敲除能力,为表征非编码序列带来有力工具,为清除病毒基因组,攻克病毒感染性疾病带来有前景的方法。
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247500351&idx=6&sn=7b04147532b6dc7d1faf37e9515a70a2&chksm=fce6b1e0cb9138f6816850889c01ff8daa0f1859892c048afcd57a6b8f6709ac217b910afa01&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

