来源:高分子科学前沿
常驻细胞分泌的动物细胞外基质(ECM),多糖和纤维蛋白,可以通过自组装或交联在基底膜和细胞间隙的界面形成凝胶网络,为周围细胞提供结构和生化支持。而用于模拟ECM凝胶的界面发自组装控制仍然具有挑战性:1)在表面或表面附近连续产生类似于细胞分泌的水凝胶成胶因子,2)水凝胶成胶因子的表面辅助沉积诱导非共价相互作用的自组装行为。前期研究人员分别通过界面酶和电化学反应创造性地实现了细胞生物表面及其它微米尺度的空间限制性自组装。然而,由于相对大的表面张力和竞争性组装/扩散行为,在受限的纳米表界面上实现超分子自组装仍然是一个挑战。
受这些工作的启发,同济大学王启刚教授团队提出一种新型的酰胺反应化学诱导质子化实现纳米表面成胶机制,在纳米界面原位嫁接低分子量凝胶成胶因子作为种子层,进一步利用酰胺反应中pH降低实现可控的自组装和凝胶化过程。相对于大尺寸生物催化剂,原位化学反应产生的高密度催化位点可以减轻扩散阻力达到最小组装浓度,在表面处或表面附近达到临界凝胶化浓度(CGC)实现成胶因子的凝胶化。具体的制备流程如图1所示,首先,通过界面酰胺化将D-多肽的成胶因子(NapGDFDFDK)接枝到纳米金纳米棒(AuNRs)上作为种子层,该过程将形成弱的多肽基的酸络合物,可同时原位实现pH从约8.5降低至6.5,反应作为连续生成质子的驱动器在界面周围诱导pH降低。在这种高质子浓度下溶解的多肽凝胶因子倾向于在反应界面周围富集和聚集,进一步通过疏水性的萘和苯环基团的π-πstaking作用而进行组装,最终原位实现成胶因子的沉积和自组装以最终获得杂化纳米凝胶(AuNRs-Gel)。
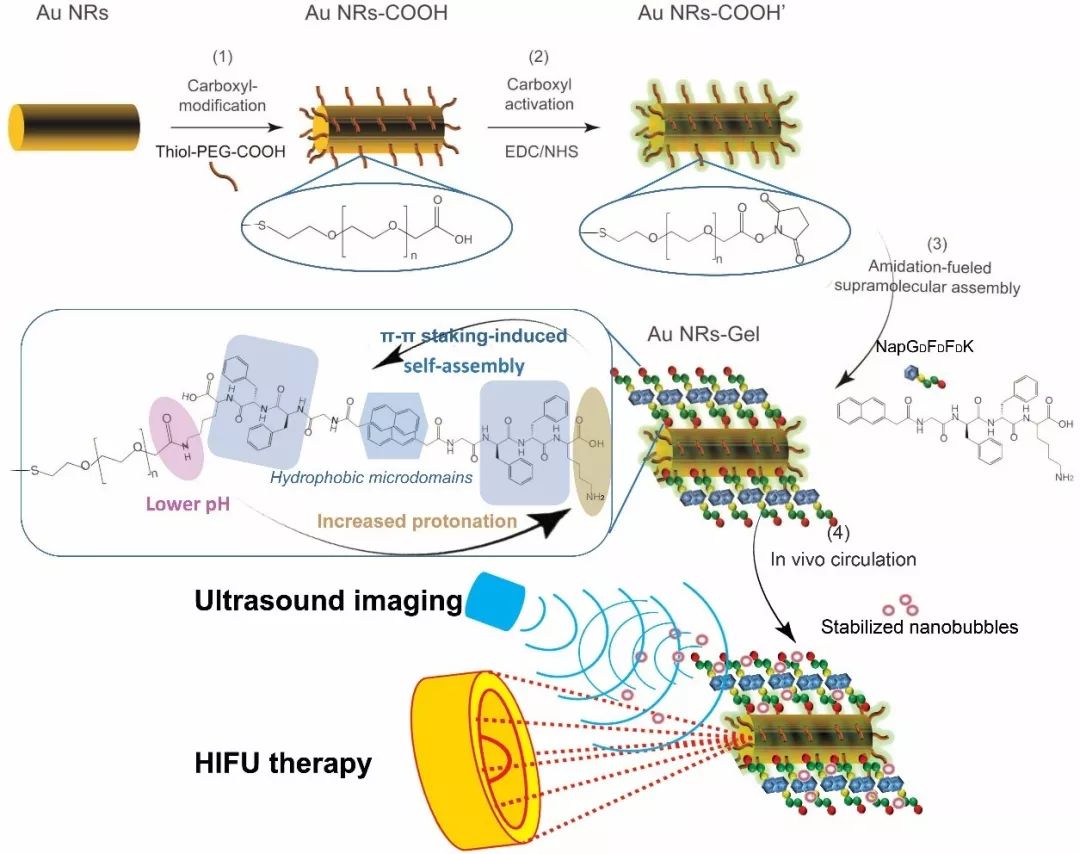
图1.酰胺反应化学诱导质子化实现纳米表面成胶过程及超声诊疗研究示意图。
设计的AuNRs-Gel具有良好富水的水凝胶网络和自组装多肽凝胶因子的丰富疏水微区,独特的网络可以提供理想的疏水性,粗糙度和多孔位置,以捕获气体作为空化种子。而较大表面张力的高粘度富水网络可以充分稳定纳米气泡,其可作为一类新型的超分子基无泡超声造影剂材料。具有良好声学特性和高热效应的无机AuNRs核可以最终构建成用于增强超声成像和成像引导强化HIFU治疗的无气泡治疗剂。
相关研究工作近期在Nano Letters上报道,同济大学化学科学与工程学院王霞副教授和于晓硕士为共同第一作者,王启刚教授为通讯作者。该研究成果得到了国家自然科学基金和国家重点研发计划等项目的支持。王启刚教授团队近年来致力于“生物氧化调控功能凝胶的制备及生物医学应用研究”,不断探索更加稳定、高效的酶催化成胶体系(Adv.Mater. 2018, 30, 1705668),并探索微/纳米凝胶用于生物诊疗研究(Nat.Commun. 2019, 10, 240,iScience, 2019, 14, 27,ACS Nano 2015, 9, 5646)及可打印凝胶用于组织工程支架(Chem. Sci. 2016, 7,2748)研究。该团队以第一或通讯作者累计发表Nature,Nat.Commun.,Adv.Mater., J. Am. Chem. Soc.和Angew. Chem. Int. Ed.等高水平论文60余篇,引用3000余次。
参考文献:
XiaWang, Xiao Yu, Xiaoshan Wang, Meiyuan Qi, Jing Pan, and Qigang Wang,One-StepNanosurface Self-Assembly of d-Peptides Renders Bubble-Free UltrasoundTheranostics,Nano Lett.,2019, DOI: 10.1021/acs.nanolett.8b04632
来源:Polymer-science 高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651717187&idx=5&sn=3b0d9c44e79805eca9c838f2a052f0d8&chksm=8b49ec06bc3e65102a46d283cabb2ded4ad7275c40b6c54b0f9967561e68f57c8a0623e3e8e0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



