来源:BioArt
责编 | 兮
当前肿瘤治疗的难点和研究重点有:肿瘤药物耐受、肿瘤迁移和肿瘤复发,很多情况下肿瘤干细胞(Cancer Stem Cells, CSCs)是罪魁祸首【1,2】。肿瘤干细胞是一群分裂相对不活跃、成瘤能力强,并有高干细胞特性的肿瘤细胞,现已在造血系统的肿瘤、乳腺癌、前列腺癌、胰腺癌、结肠癌、皮肤癌和脑瘤等多种不同组织来源的肿瘤中发现有这类细胞的存在【3-11】。由于肿瘤干细胞有上述区别于主体肿瘤细胞的特点,传统的能有效杀死主体的处于分裂中的肿瘤细胞的治疗手段(如:化学疗法和放射疗法等)并不能有效伤害肿瘤干细胞, 它们从而能在治疗中生存下来介导肿瘤药物耐受、肿瘤迁移和肿瘤复发【5,12,13】。因此,亟需研究这些拥有高干细胞特性并且成瘤能力又很强的肿瘤干细胞的生物学特性,探究它们所依赖的分子和细胞机制,为开发出靶向这些肿瘤干细胞的治疗手段提供依据。
代谢异常是肿瘤的标志性特点之一【14】。 近年来大量涌现的证据表明肿瘤干细胞有显著区别与肿瘤主体分裂细胞和正常体细胞的线粒体代谢【12,15-18】。肿瘤主体分裂细胞主要依赖于糖酵解来获得能量(Warburg Effect),而肿瘤干细胞有特殊的线粒体代谢并且往往依赖线粒体功能而存活。大数据分析发现,对线粒体氧化磷酸化通路(mitochondrial oxidative phosphorylation, OXPHOS)第一个蛋白复合体有抑制作用的糖尿病药物metformin对肿瘤有一定抑制效果【19】。也有一些OXPHOS通路第一个蛋白复合体的抑制剂已证明在动物肿瘤模型中有效,且在进行肿瘤治疗的临床试验【20,21】。
近日,美国纪念斯隆-凯特琳癌症中心的Luis F. Parada团队在Nature上发表长文Gboxin is an oxidative phosphorylation inhibitor that targets glioblastoma,利用高通量筛选揭示了小分子Gboxin可以特异性地抑制原代神经胶质瘤母细胞生长。

在此工作中,研究者用大规模小分子筛选来研究原代培养的具有高干细胞特性的神经胶质母细胞瘤细胞(HTS 细胞)的生物学特性。在初筛得到的几千个能有效杀死HTS 细胞的小分子中,去除了那些对原代培养的野生型(MEF/Astrocyte)细胞亦有杀伤能力的小分子。再经过一系列筛选,最终得到了3个小分子, 其中包括Gboxin。
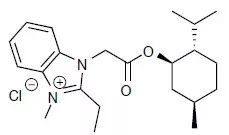
Gboxin化学式
Gboxin能高特异性地杀死 HTS 细胞(对野生型细胞只有在高浓度时有微弱抑制作用)。进一步发现Gboxin能线粒体内膜电势差依赖地阻断氧化磷酸化通路中的第五个蛋白复合体,野生型细胞能通过打开线粒体通透通道(mitochondrial permeability pore; mPTP )维持较低的线粒体内膜电势差来逃脱Gboxin对OXPHOS通路的抑制;而mPTP在HTS 细胞中是不活跃的,Gboxin对OXPHOS通路的抑制是持续并且是不可逆的,最终导致HTS细胞的凋亡。用代谢稳定的Gboxin衍生物给药处理小鼠4周,没有出现对小鼠的明显毒性,而能有效抑制神经胶质母细胞瘤的生长,显示Gboxin类药物有高的安全性。进一步实验表明:线粒体mPTP在多种不同人肿瘤细胞系中是不活跃的,这些细胞显示对Gboxin敏感,表明Gboxin类药物的作用可能不限于神经胶质母细胞瘤。
总之,这项研究表明具有高干细胞特性的肿瘤细胞有区别于正常细胞的线粒体特征,而针对肿瘤细胞线粒体内膜高电势差和不活跃的mPTP是一个设计肿瘤药物的好思路。
原文链接:
https://www.nature.com/articles/s41586-019-0993-x
制版人:珂
参考文献
1. Alcantara Llaguno, S. R., Xie, X. & Parada, L. F. Cell of Origin and Cancer Stem Cells in Tumor Suppressor Mouse Models of Glioblastoma. Cold Spring Harb Symp Quant Biol 81, 31-36, doi:10.1101/sqb.2016.81.030973 (2016).
2. Batlle, E. & Clevers, H. Cancer stem cells revisited. Nat Med 23, 1124-1134, doi:10.1038/nm.4409 (2017).
3 Alcantara Llaguno, S. R. & Parada, L. F. Cell of origin of glioma: biological and clinical implications. Br J Cancer 115, 1445-1450, doi:10.1038/bjc.2016.354 (2016).
4. Lan, X. et al. Fate mapping of human glioblastoma reveals an invariant stem cell hierarchy. Nature 549, 227-232, doi:10.1038/nature23666 (2017).
5. Chen, J. et al. A restricted cell population propagates glioblastoma growth after chemotherapy. Nature 488, 522-526, doi:10.1038/nature11287 (2012).
6. Pece, S. et al. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell 140, 62-73, doi:10.1016/j.cell.2009.12.007 (2010).
7. Bonnet, D. & Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med 3, 730-737, doi:DOI 10.1038/nm0797-730 (1997).
8. Wang, X. et al. A luminal epithelial stem cell that is a cell of origin for prostate cancer. Nature 461, 495-U461, doi:10.1038/nature08361 (2009).
9. Hermann, P. C. et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell 1, 313-323, doi:10.1016/j.stem.2007.06.002 (2007).
10. Schepers, A. G. et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas. Science 337, 730-735, doi:10.1126/science.1224676 (2012).
11. Driessens, G., Beck, B., Caauwe, A., Simons, B. D. & Blanpain, C. Defining the mode of tumour growth by clonal analysis. Nature 488, 527-530, doi:10.1038/nature11344 (2012).
12. Viale, A. et al. Oncogene ablation-resistant pancreatic cancer cells depend on mitochondrial function. Nature 514, 628-632, doi:10.1038/nature13611 (2014).
13. Parada, L. F., Dirks, P. B. & Wechsler-Reya, R. J. Brain Tumor Stem Cells Remain in Play. J Clin Oncol 35, 2428-2431, doi:10.1200/JCO.2017.73.9540 (2017).
14. Hanahan, D. & Weinberg, R. A. Hallmarks of cancer: the next generation. Cell 144, 646-674, doi:10.1016/j.cell.2011.02.013 (2011).
15. Viale, A. & Draetta, G. F. Metabolic Features of Cancer Treatment Resistance. Recent Results Cancer Res 207, 135-156, doi:10.1007/978-3-319-42118-6_6 (2016).
16. Caro, P. et al. Metabolic Signatures Uncover Distinct Targets in Molecular Subsets of Diffuse Large B Cell Lymphoma. Cancer Cell 22, 547-560, doi:10.1016/j.ccr.2012.08.014 (2012).
17. Cole, A. et al. Inhibition of the Mitochondrial Protease ClpP as a Therapeutic Strategy for Human Acute Myeloid Leukemia. Cancer Cell 27, 864-876, doi:10.1016/j.ccell.2015.05.004 (2015).
18. Bosc, C., Selak, M. A. & Sarry, J. E. Resistance Is Futile: Targeting Mitochondrial Energetics and Metabolism to Overcome Drug Resistance in Cancer Treatment. Cell Metabolism 26, 705-707, doi:10.1016/j.cmet.2017.10.013 (2017).
19. Libby, G. et al. New users of metformin are at low risk of incident cancer: a cohort study among people with type 2 diabetes. Diabetes Care 32, 1620-1625, doi:10.2337/dc08-2175 (2009).
20. Naguib, A. et al. Mitochondrial Complex I Inhibitors Expose a Vulnerability for Selective Killing of Pten-Null Cells. Cell Rep 23, 58-67, doi:10.1016/j.celrep.2018.03.032 (2018).
21. Molina, J. R. et al. An inhibitor of oxidative phosphorylation exploits cancer vulnerability. Nat Med 24, 1036-1046, doi:10.1038/s41591-018-0052-4 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468438&idx=4&sn=0774b2308735d5b6660c3f406a61ab77&chksm=84e2e762b3956e748ec9648db00a2e1370c2b165ebc54830dc7a8dfef7ec49402ffa7cc140e8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



