来源:X-MOL(x-mol.com)
光学纯的环戊烯酮是合成天然产物及药物分子的重要结构单元,因而化学家们一直致力于开发这类重要化合物对映选择性合成的方法。目前常用的方法包括化学法或酶促进的动力学拆分、母体环戊烯酮的不对称官能团化、其他手性合成子的衍生化等,这些策略虽然有效,但如果从简单的原料出发,利用不对称的Pauson-Khand反应或Nazarov环化在构建环单元时引入手性将会大大提高合成的效率。但以往很少采用不对称Nazarov环化的方式构建手性环戊烯酮,主要是由于所需底物的结构复杂特殊,缺乏通用性。2003年,Trauner课题组报道了首例催化不对称的Nazarov环化反应,随后在此基础上发展的方法在很大程度上都取决于底物的设计,反应的关键在于如何提高二烯基酮的反应活性,并调控区域和立体选择性(图1a)。人们通常以相邻的杂原子稳定氧杂烯丙基阳离子,或通过相邻的吸电子基团或β-芳基取代基使二烯基酮发生极化,由此活化二烯基酮底物。2013年,Rawal等人报道了非活化二烯基酮的Nazarov环化。然而,反应底物中其中一个烯基仍需要位于六元环单元内,限制了该方法的适用范围。如何实现简单烷基取代非环二烯基酮的不对称Nazarov环化成为人们思考的问题。
德国马克斯•普朗克煤炭研究所的Benjamin List课题组发展了一类新颖的手性、强酸性的Brønsted酸亚氨基双磷酰亚氨酸酯(IDPis),并可成功将其用于各种不对称转化中。他们设想这些高活性的催化剂可能会适用于二烯基酮的Nazarov环化,其空间受限的手性微环境不仅会诱导不对称反应,而且还可以通过增加二烯基酮s-反式/s-反式构象异构体的浓度来提高反应活性(图1b)。近日,他们在J. Am. Chem. Soc.上报道了相应的研究成果,实现了简单、非环、烷基取代二烯基酮的催化不对称Nazarov环化。
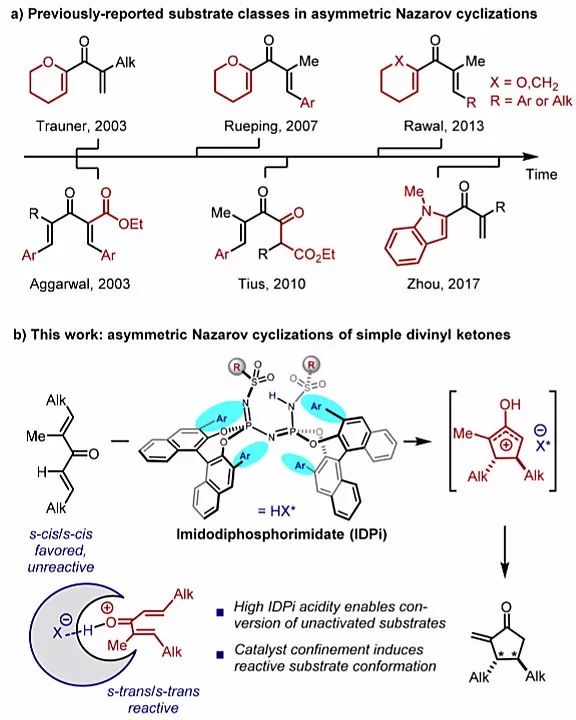
图1. 研究背景及该论文的工作。图片来源:J. Am. Chem. Soc.
作者以非环二烯基酮1a为模型底物,在甲苯中25 ℃下使用各种手性Brønsted酸催化剂对反应进行了研究(图2)。实验发现,相对弱酸性且空间受限的Brønsted酸如4a和4b参与反应都得不到任何产物。使用Rueping等人报道的Nazarov环化催化剂N-三氟甲磺酰基磷酰胺4c转化率较差,区域选择性和立体选择性也不够理想。即使是酸性强的IDPi催化剂4d(其中Ar = Ph)在该反应条件下也是无活性的。基于作者的假设,IDPi骨架对于s-反式/s-反式构象异构体的增加至关重要,作者尝试了在3,3'位置具有更大空间位阻的π取代基IDPi催化剂,使用IDPi催化剂4e和4f(其中Ar = 2-三亚苯基)时,能以良好的产率及优异的非对映选择性和区域选择性(均> 20:1)形成2a,对映选择性中等。IDPi催化剂4f在控制底物的对映选择性方面具有最佳的效果,因而用于进一步优化。当反应在-20 ℃下进行时,底物1a完全转化为烯酮2a,且具有优异的区域选择性(> 20:1)、非对映异构选择性(> 20:1)和对映选择性(97:3)。
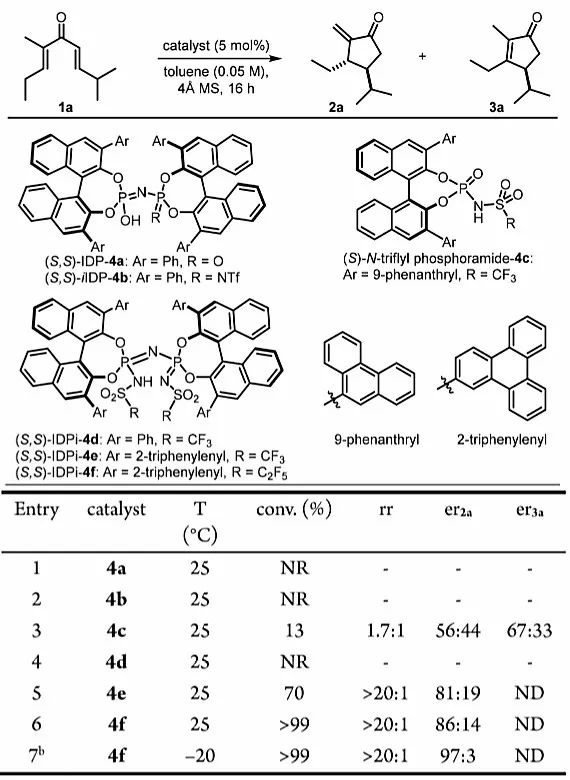
图2. 反应的发展及条件优化。图片来源:J. Am. Chem. Soc.
有了最佳反应条件,作者接下来探讨了该反应的底物适用范围。R2取代基为线性(1b)、支链(1c,1d)和环状(1f-1h)脂肪取代基时,底物都具有良好的兼容性,能以良好的产率、优异的区域和对映选择性得到相应的烯酮。在该反应条件下,环丙基取代的底物1e产生两种区域异构体2e和3e(rr = 1:1),可能是由于环丙基单元具有独特的π特征,内型环状异构体3e的热力学稳定性增加。含有氯代烷基的底物1j也可顺利参与反应,产物还可用于随后的环化或官能化。底物1k参与反应时无Friedel-Crafts副产物生成。接下来,作者将注意力转向R1为甲基取代基的二烯基酮1l和1m,1l反应得到烯酮2l,产物为单一区域异构体(rr> 20:1),具有优异的对映选择性(95:5)。对于位阻较大的取代二烯基酮1m(R2 = t-Bu),反应需要略高的催化剂负载量(7 mol%),能以良好的收率(72%)得到环戊烯酮2m,并且具有优异的对映选择性(97:3)。邻溴苯基二烯基酮1n能以88:12的对映选择性转化为2n,2n的绝对构型在衍生化后确定为(3S,4R),所有其它产物的相对构型都通过与此类比进行确定。
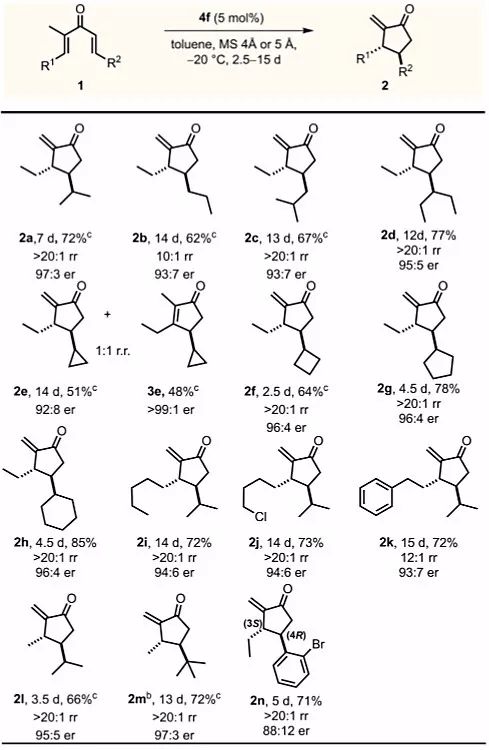
图3. 底物适用范围的考察。图片来源:J. Am. Chem. Soc.
为了研究不对称Nazarov环化的机理,作者提出了以下两种假设,第一种中游离的催化剂处于休眠态,第二种是氧杂烯丙基阳离子和催化剂4f的阴离子形成共价中间体。为了区分这两种反应机制,作者使用1H NMR分析进行了动力学研究。如图4a所示,反应速率和原料浓度之间的线性相关性表明,在稳态近似法假设下反应对底物来说是一级反应。因此,作者认为游离催化剂在催化循环中呈休眠态,并与底物配位形成配合物A(图4b),随后发生4π电环化产生氧杂烯丙基离子对B,B进行动力学控制的去质子化(路径a),再生催化剂并释放产物。
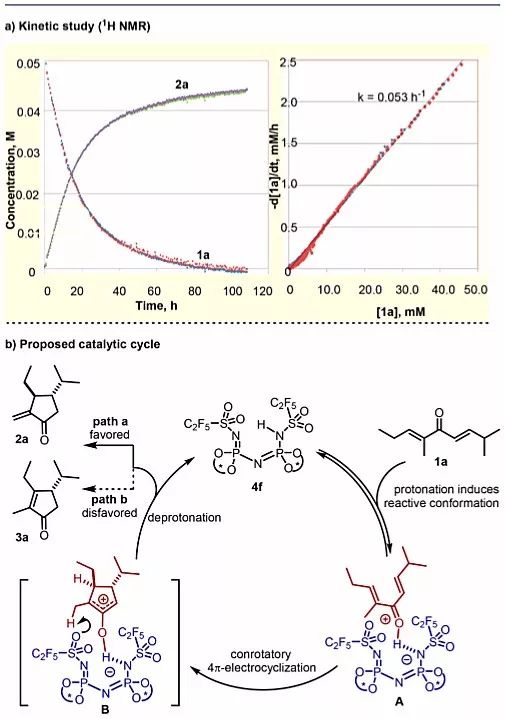
图4. 动力学研究及可能的反应机理。图片来源:J. Am. Chem. Soc.
作者还探讨了环戊烯酮产物的应用价值(图5)。环戊烯酮2a可作为Michael受体参与Corey-Chaykovsky环丙烷化和Mukaiyama-Michael加成反应,得到产物环戊酮7和9,对映选择性没有受到明显影响。2a的α-亚甲基化单元在过量的甲磺酸条件下可以异构化为热力学更稳定的全取代环戊烯酮3a,同样保持优异的对映选择性。此外,2a发生Luche还原,能以97%的收率得到烯丙醇10,且具有优异的非对映选择性(dr> 20:1),10可以经Mitsunobu反应修饰嘌呤得到化合物12,同样具有优异的对映选择性。
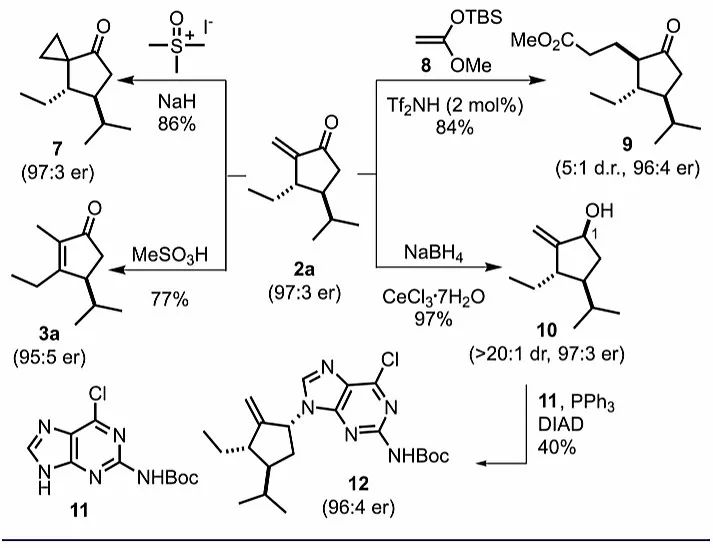
图5. 环化产物的衍生化。图片来源:J. Am. Chem. Soc.
总结
Benjamin List课题组发展了一种高效的催化剂,使用酸性强且空间受限的Brønsted酸实现了简单、非环、脂肪族取代二烯基酮的不对称Nazarov环化反应。反应的关键在于IDPi骨架结构可诱导二烯基酮s-反式/s-反式构象异构体的增加,因而增强了底物的反应活性,促进环化发生。该反应能以良好的产率,优异的对映选择性、区域选择性和非对映选择性得到各种环戊烯酮产物,具有良好的底物适用性,有望在具有环戊烯酮单元的生物活性天然产物的高效构建中发挥重要的作用。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657608580&idx=2&sn=083952611f74a7ca65b46f8baf8ed111&chksm=80f7ca54b7804342e42f7fa0e146112d2ccd405407364f9681ea89f8465007e17fe702acb4c6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



