来源:X-MOL(x-mol.com)
三阴性乳腺癌(triple negative breast cancer,TNBC)基本不表达目前大多数治疗乳腺癌药物的靶蛋白,这就导致只有奥拉帕尼可以治疗一小部分携带BRCA突变的TNBC病人,其他TNBC病人则没有靶向药可以选择,同时标准的化疗通常效果不佳,副作用大。因此寻找针对TNBC的靶点并开发靶向疗法迫在眉睫。
近日美国马里兰大学的Xiaoming He教授与印第安纳大学医学院的Xiongbin Lu教授等研究人员,通过临床数据分析找到了一个针对TNBC的治疗靶点POLR2A,他们开发了一种酸响应激活的纳米颗粒携载靶向POLR2A的小干扰RNA(small interfering RNA,siRNA),利用纳米颗粒在酸响应条件下释放二氧化碳促进纳米颗粒实现内含体逃逸的特点,增强POLR2A siRNA(siPol2)的基因沉默效果。通过细胞和动物水平的实验,研究人员证明了精准靶向沉默POLR2A是一个治疗TNBC的有效策略。相关研究成果于发表在Nature Nanotechnology 上。
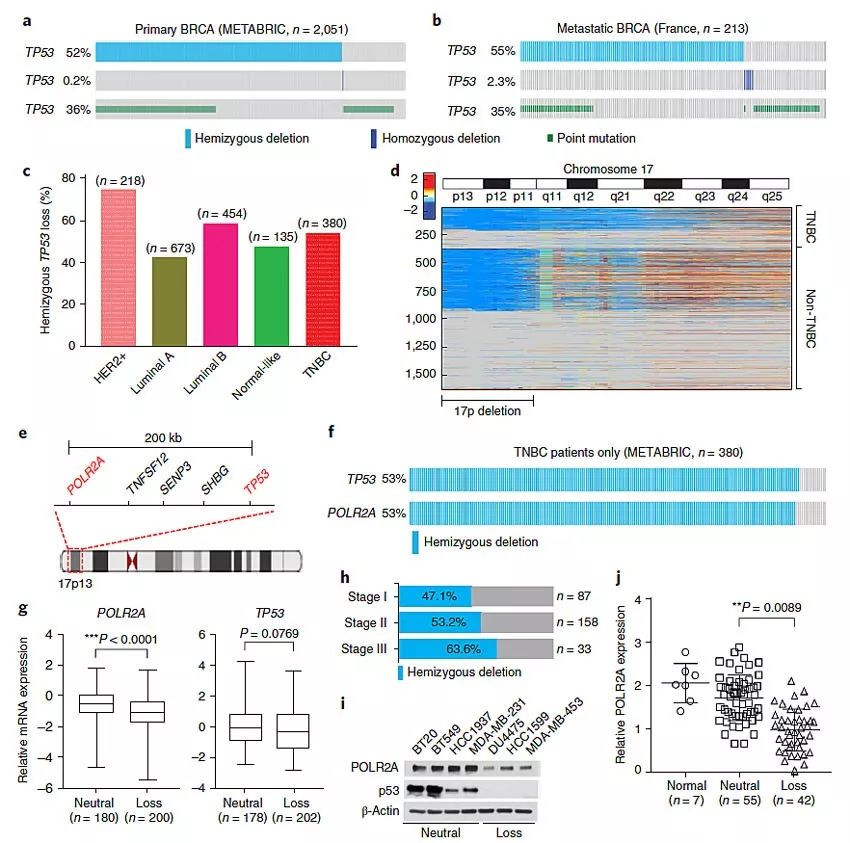
图1. POLR2A总是与TP53一起发生突变或者缺失。图片来源:Nat. Nanotech.
首先,研究人员是如何找到POLR2A这个靶点的呢?
由于TP53是TNBC最常见的突变或者缺失的基因,因此在研究初期,他们对乳腺癌病人的数据进行了分析,结果发现大部分TNBC病人(53%)TP53的突变都是半合子缺失,也就是说染色体的单链发生了突变。有意思的是POLR2A和TP53两个基因距离较近,TP53的半合子缺失突变导致POLR2A也出现了半合子缺失突变。POLR2A负责表达RNA聚合酶2复合物中最大的亚单元,与细胞生存息息相关,尽管半合子缺失的POLR2A(POLR2Aloss)可以维持癌细胞生存,但是研究人员认为这类癌细胞应该对POLR2A的抑制更敏感。因此他们想到利用靶向POLR2A的siRNA去抑制肿瘤细胞的POLR2A表达也许是治疗TNBC的良策。为此,他们设计了一种新型纳米颗粒携载siPol2,试图利用纳米颗粒克服siRNA在血液中易降解、难以进入细胞以及难以从内含体逃逸的问题。
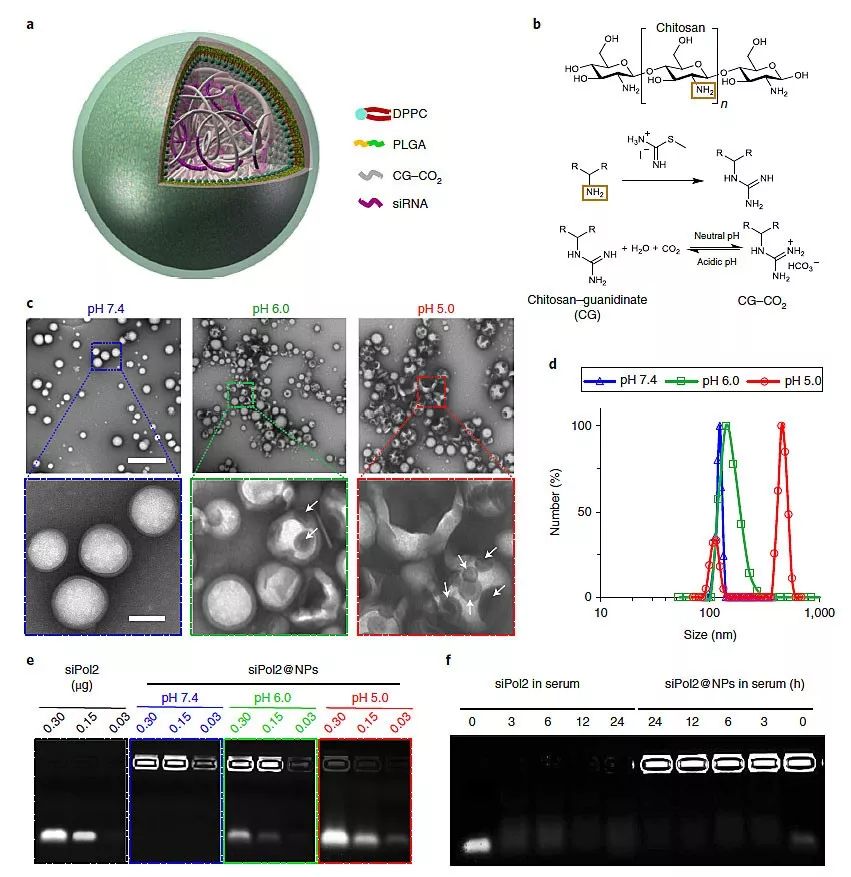
图2. 纳米颗粒包载并保护siRNA免被降解。图片来源:Nat. Nanotech.
研究人员设计的纳米颗粒核心材料为侧链为胍基的壳聚糖(Chitosan–guanidinate,CG),胍基可与CO2可逆性结合,中性条件下结合CO2形成碳酸盐,在酸性条件下可以释放出CO2和胍基,同时胍基和壳聚糖上的氨基可以结合带负电的siRNA。研究人员通过双乳化法制备了PLGA和DPPC包载CG-siPol2的纳米颗粒siPol2@NPs,粒径为110 nm左右。这种纳米颗粒在pH=7.4的条件下比较稳定,但在pH=6.0或者5.0的情况下就会快速变大,这表明酸性条件下纳米颗粒可以释放CO2。这种纳米颗粒可以很好地保护siRNA免被血清中的酶降解,还可以在酸性条件下快速释放出siRNA。为了研究纳米颗粒在细胞内的运输和分布,研究人员将siPol2进行了荧光标记,然后与细胞共孵育后利用CLSM进行观察,发现在没有CO2的情况下siPol2始终在内涵-溶酶体中,而在有CO2的情况下,很多siPol2都出现在细胞质中,这表明纳米颗粒在酸性条件下释放的CO2促进了siPol2的内含体逃逸,这主要是由于纳米颗粒产生的CO2会导致内含体破裂,导致siPol2进入细胞质中。
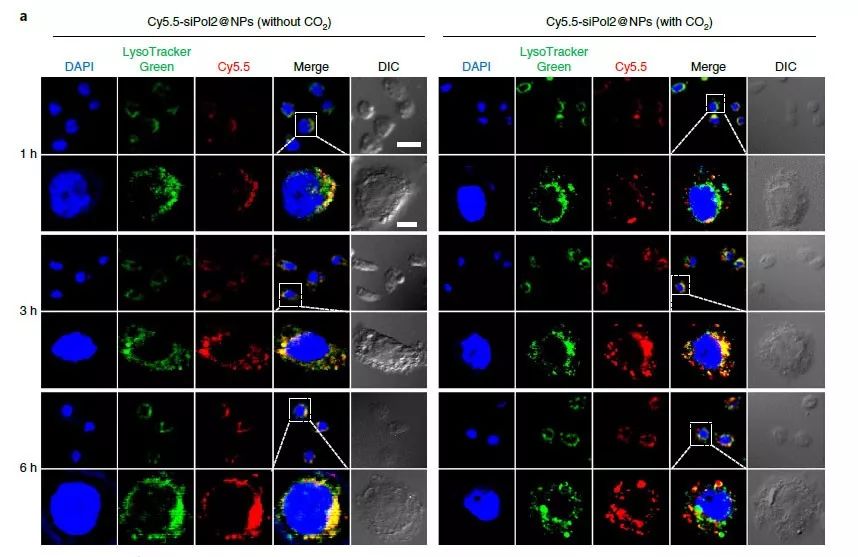
图3. 包载CO2的纳米颗粒促进siRNA的内含体逃逸。图片来源:Nat. Nanotech.
接下来研究人员研究了抑制POLR2A对POLR2Aloss的癌细胞的影响。研究人员使用TNBC细胞系MDA-MB-453细胞(POLR2Aloss)作为实验组,以MDA-MB-231细胞(POLR2Aneutral,该基因无突变)为对照组。研究人员发现携载无效siRNA的颗粒siNT@NPs对细胞无毒性,这表明纳米颗粒本身不会对细胞造成杀伤。但是siPol2@NPs可以以浓度相关的毒性杀伤MDA-MB-453细胞,却对MDA-MB-231细胞无明显杀伤作用,这是由于MDA-MB-231细胞中POLR2A的表达水平高于MDA-MB-453细胞。剂量试验显示,siPol2的浓度为1.0 μg ml-1 就可以完全抑制MDA-MB-453细胞中POLR2A的表达,但是MDA-MB-231细胞仍然会表达该蛋白(尽管表达水平有所下降)。这表明抑制POLR2A的表达可以选择性杀伤POLR2Aloss TNBC细胞。研究人员还在多种细胞上进行了实验,得到了相似的结果。
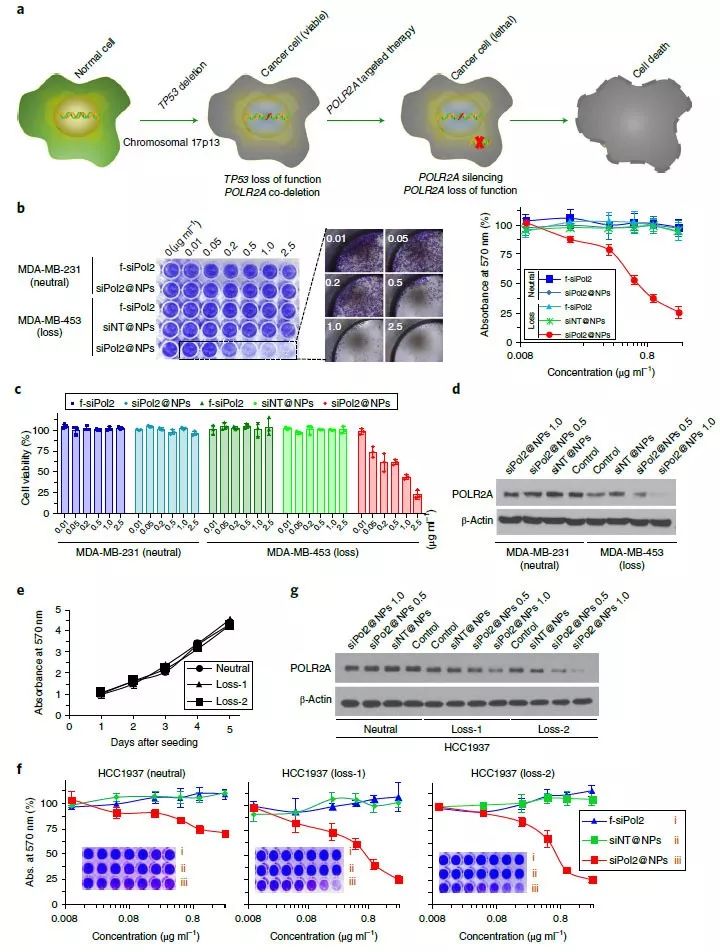
图4. siPol2@NPs特异性杀伤POLR2Aloss的TNBC癌细胞。图片来源:Nat. Nanotech.
最后,研究人员在小鼠身上进行了肿瘤治疗实验,以探索siPol2@NPs靶向抑制POLR2A表达对于肿瘤生长的影响。研究人员首先在小鼠第四腹股沟乳腺脂肪垫左右分别植入了POLR2Aloss和POLR2Aneutral 的HCC1937细胞,一周后尾静脉注射Cy5.5标记的siPol2@NPs,8小时后进行活体成像发现颗粒显著富集在肿瘤部位,这主要是由于肿瘤的EPR效应。研究人员接下来进行了治疗实验,每周给药两次。期间小鼠的体重没有明显变化,治疗后各器官没有明显的炎症,无肝毒性,血清中各细胞因子的水平虽然在给药后6小时会出现上升的现象,但是在1天后就恢复到正常水平,这些数据都表明这种纳米颗粒生物安全性较好。研究人员发现治疗4周后,siPol2@NPs显著抑制了POLR2Aloss肿瘤的生长,但是对POLR2Aneutral 无明显治疗效果,蛋白水平的检测发现POLR2Aloss肿瘤中几乎不表达POLR2A蛋白,这意味着siPol2@NPs可以通过抑制POLR2A对POLR2Aloss肿瘤进行杀伤。为了进一步验证这些结果,研究人员还使用了MDA-MB-453细胞(POLR2Aloss)和MDA-MB-231(POLR2Aneutral)细胞进行了相同的实验,结果完全一样,siPol2@NPs显著抑制了MD-MB-453肿瘤的生长,而对MDA-MB-231肿瘤无明显影响。
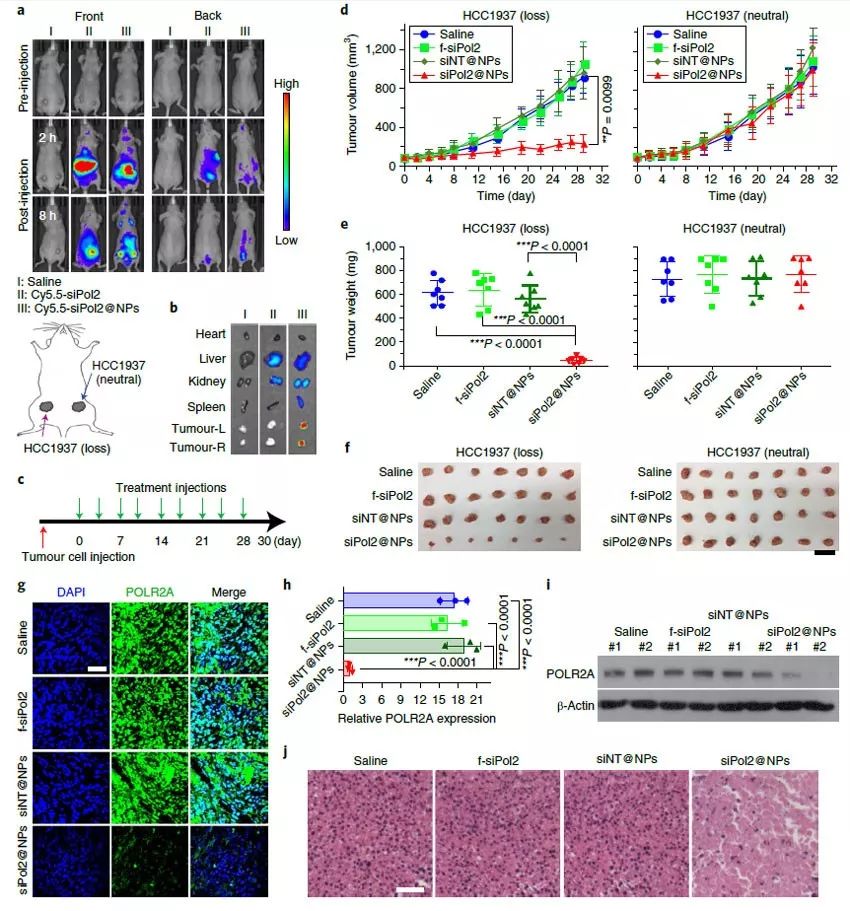
图5. siPol2@NPs特异性抑制POLR2Aloss的TNBC肿瘤的生长。图片来源:Nat. Nanotech.
总结
首先,本研究最大的亮点在于成功找到了一个治疗TNBC病人的靶点POLR2A,并在动物水平进行了验证,表明靶向抑制该基因的表达确实可以治疗POLR2Aloss的TNBC。这给一半以上的TNBC病人带来希望,有望引导科研界和药企开发针对该基因/蛋白的特效药。其次,本研究开发了一种酸响应的纳米颗粒,可以在内含-溶酶体中微酸环境下释放出CO2破坏内含体和溶酶体,这显著增强了siRNA的内含体逃逸。事实上内含体逃逸是基因、蛋白药物递送面临的一大挑战,大多数纳米颗粒进入细胞都要经过内涵-溶酶体这条途径,有研究表明大部分纳米颗粒进入内涵溶酶体之后很难释放到细胞质中,而这些大分子药物对于酸性环境、各种酶都比较敏感,因此极易失活。此外,大分子药物从双乳化体系内部释放的速度也很慢,这导致药物很难在细胞质中快速达到有效浓度。这项研究巧妙地利用胍基与CO2的可逆性结合,利用生物相容性良好的材料制备了纳米颗粒,利用溶酶体的酸性环境激活颗粒释放CO2,在促进大分子药物内含体逃逸的过程中也促进了大分子药物从颗粒内部的释放,可谓一石二鸟。因此,这类纳米载体还可以用于质粒、mRNA、蛋白质等大分子药物的胞质输送。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657608233&idx=2&sn=efdbca83e24c34a7ebbd0ed82c7a8ba3&chksm=80f7cbf9b78042ef0e11fa29f347fd3cd31ce1a6feb5c8d3b756064134b1871e938724949bc5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



