树突状细胞(DC)是一类重要的天然免疫细胞,在激活机体抗病原体免疫应答及维持自身免疫耐受过程中发挥关键性调控作用。DC的体内迁移对于其成熟活化及功能调控至关重要,DC迁移紊乱可能导致DC在炎症部位的过度聚集及活化,导致组织过度炎症,甚至引发炎症性疾病的发生。探索DC迁移过程的调控机制对于深入了解DC在天然免疫与炎症中的作用,并寻找DC迁移或活化异常引发的炎症性疾病的潜在治疗靶点具有重要意义。
表观遗传学机制通过DNA甲基化、组蛋白修饰、及非编码RNA(long noncoding RNAs,lncRNAs)等手段调控基因表达,在众多生理和病理过程中发挥关键性调控作用。探究表观遗传学机制在免疫应答及调控中如何发挥多样化的功能是近年来免疫学研究的热点领域。目前对于DC迁移的表观调控机制尚缺乏了解,特别是长链非编码RNA在DC迁移及炎症性疾病中的作用未见报道。
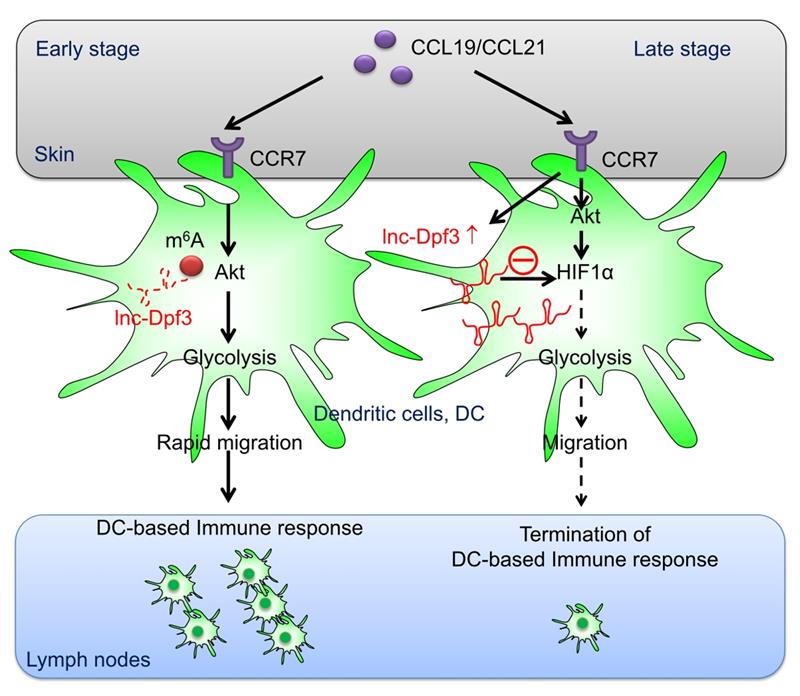
医学免疫学国家重点实验室主任曹雪涛院士与实验室刘娟副教授等发现,一条新的lncRNA lnc-Dpf3在DC迁移及其介导的炎症性疾病中发挥关键性调控作用。研究团队通过lncRNA测序筛选发现,lnc-Dpf3在趋化因子受体CCR7介导的DC迁移过程中表达上调,并能够反馈性抑制炎症状态下DC向刺激淋巴组织的迁移。通过制备树突状细胞条件性敲除lnc-Dpf3的小鼠,发现lnc-Dpf3基因缺失能导致CCR7介导的DC迁移增强,继而引发小鼠在接触性超敏反应过程中T细胞介导的适应性免疫过度活化及组织炎症损伤加剧。静息状态下,lnc-Dpf3 RNA携带m6A修饰,并被m6A reader蛋白YTHDF2结合,从而介导lnc-Dpf3的RNA发生降解;而CCR7信号能够抑制DC中lnc-Dpf3 RNA m6A修饰,解除RNA降解从而上调其表达。进一步,研究者通过代谢组学和转录组测序等证实, lnc-Dpf3能够负反馈抑制CCR7介导的HIF-1α活化及糖酵解基因LDHA表达,从而抑制DC的糖酵解水平,最终负向调控CCR7介导的DC迁移和炎症反应。
该研究揭示了表观遗传修饰与代谢的交叉调控在天然免疫应答及炎症中的重要作用,有助于解释与树突状细胞过度迁移相关的炎症性疾病的发生机制,为设计和探索疾病新型治疗方法提供了新的思路与依据。
来源:中国免疫学会
原文链接:http://www.csi.org.cn/article/content/view?id=851
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



