来源:Bio生物世界
过去研究表明,启动Th17细胞分化,需要至少两个细胞因子:白细胞介素6(interleukin-6, IL-6)和转化生长因子-β(transforminggrowth factor-β, TGF-β),它们的共同作用能诱导Th17首要转录因子RORγt的稳定高表达,从而打开Th17细胞分化的大门,但其中的分子机理尚缺乏了解。
顺式调控元件(Cis-regulatory elements,其中包括保守非编码序列)能通过与转录因子、表观调控因子等相互作用,在T细胞分化和命运控制中扮演重要角色。但此前关于辅助性T细胞亚群的相关研究主要集中在细胞因子的顺式调控机制方面,譬如董晨团队曾在2007年首先开启Th17表观和顺式调控机制研究(J Biol Chem 282:5969-72),并在2012年发现了调控Il17表达和Th17细胞分化的关键增强子序列CNS2 (Immunity,236:23-31)。
2020年8月21日,清华大学免疫学研究所董晨院士团队在 Immunity 杂志上发表题为:The conserved non-coding sequences CNS6 and CNS9 controlcytokine-induced Rorc transcription during T helper 17 celldifferentiation 的研究论文。
该研究发现起始Th17细胞分化所必需的两个细胞因子IL-6和TGF-β,通过与Rorc基因位点两个不同的保守非编码DNA序列(conserved non-coding sequence, CNS)相互作用,协同调控RORγt的表达及Th17细胞分化。

在该研究中,研究人员利用生物信息学手段首先在Rorc基因(编码RORγt)位点确定了11个保守非编码DNA序列CNS1-11,并利用CRISPR-Cas9基因编辑技术构建了CNS6和CNS9的敲除小鼠。
实验分析表明,CNS6或者CNS9缺失,并不影响RORγt阳性先天性免疫细胞亚群的功能和发育,但却导致了RORγt阳性CD4+T细胞(即Th17细胞和Tr17细胞)的分化缺陷,以及小鼠对实验性自身反应性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)诱导产生不同程度的不敏感。
这一发现进一步证实先天性和适应性免疫系统之间存在迥异的机制控制RORγt和IL-17阳性细胞类群的分化和发育。
有意思的是,研究人员进一步发现,CNS9主要响应IL-6而非TGF-β信号刺激,并通过与STAT3的相互作用,对整个Rorc基因位点(包括CNS6)的染色体构象开启具有关键作用。而TGF-β下游的转录因子如c-MAF和SMAD蛋白,只能通过与CNS6而非CNS9相互作用,调控Rorc的转录表达。
此外,研究人员还发现 CNS6 在一定程度上能和STAT3相互作用,并对IL-6单独培养条件下诱导的少量RORγt表达有重要作用,但CNS9的缺失能造成比CNS6缺失更为严重的Th17细胞分化缺陷,这一方面体现了表观遗传在基因表达上的关键调控作用,另一方面预示着可能还存在未知的TGF-β应答顺式调控序列。
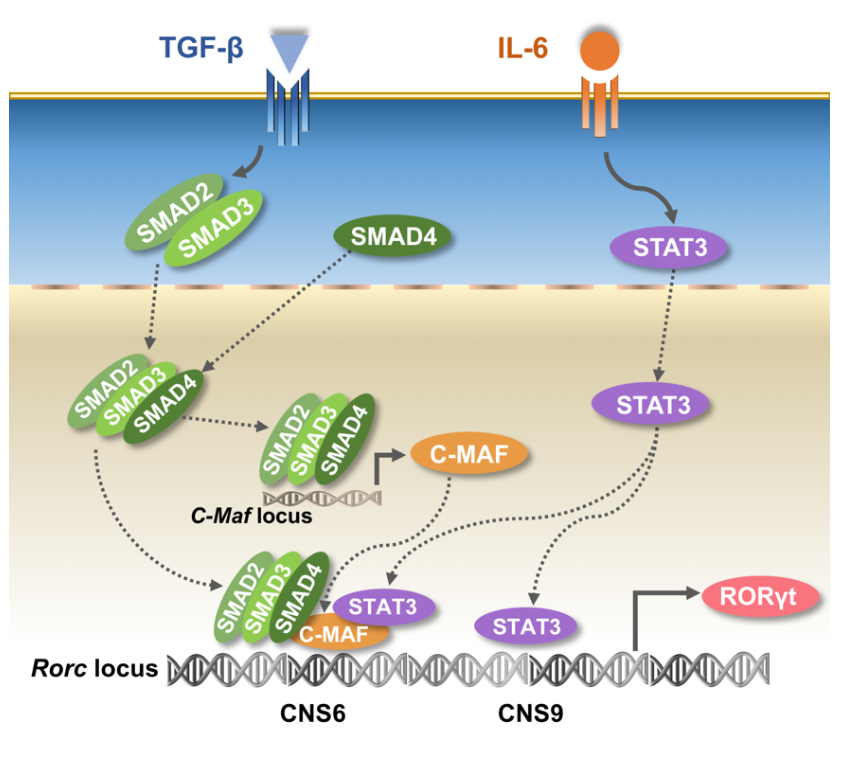 CNS6和CNS9介导Th17细胞中IL-6和TGF-β信号诱导的RORγt表达
CNS6和CNS9介导Th17细胞中IL-6和TGF-β信号诱导的RORγt表达这些发现首次揭示了IL-6和TGF-β下游信号通过与不同的顺式调控元件相互作用,从表观和分子水平协同调控RORγt的表达和Th17细胞分化。此外,该研究也是继Foxp3基因之后,首次在辅助性T细胞亚群中系统研究首要转录因子相关的顺式调控机制。
来源:ibioworld Bio生物世界
原文链接:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247506951&idx=4&sn=0e418219122bdeb0d05285afe2295462&chksm=fbf628d2cc81a1c4185ae70c49febdc380f34fd627d8e00e159c4c7e8a3e0bd627e01c555f49#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



