来源:ACS美国化学会
英文原题:From Selenite to Diselenide-containing drug delivery system
通讯作者: 许华平,清华大学
作者:Chenxing Sun (孙臣兴), Yizheng Tan (谭以正), Huaping Xu (许华平)
纳米材料在癌症治疗中已然发挥了重要的作用,基于纳米材料的载运能力,通过运载多种化疗药物或者靶向分子,或可实现多种治疗手段的联合治疗。但是目前对纳米材料的研究,大多局限于它的药物运载或者靶向递药等方面。如何设计出具有多功能性的纳米材料,使得其在载药功能的基础上,获得其他的功能性,如潜在的癌症治疗能力,甚至潜在的免疫治疗能力,需要更多的研究。许华平教授课题组一直致力于含硒高分子相关领域的研究。双硒键,作为一种氧化还原双重响应的化学键,也已经应用到纳米递送载体的研究当中。之前的研究者的工作大多表明,无机亚硒酸具有一定的抑制细胞癌变以及癌症治疗的作用。也有相关的研究工作表明,低剂量的无机亚硒酸就可以激活基于NK细胞的免疫治疗。双硒键具有较为灵敏的氧化响应能力,在氧化刺激下,会发生氧化断键生成有机亚硒酸。考虑到二者结构的相似性,该课题组认为含双硒的纳米材料在受到氧化刺激后,可能会同样具有抗癌以及激活免疫的能力。并基于此开展了相关的研究工作。
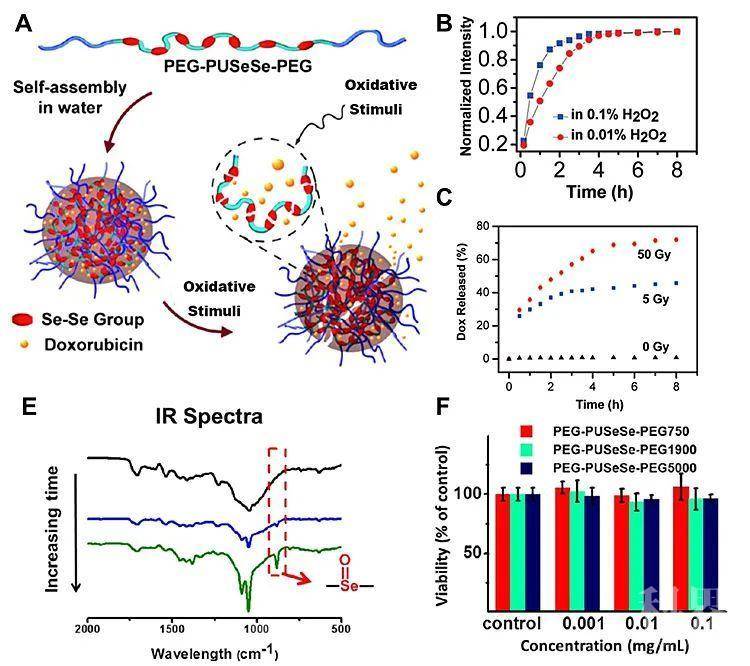
在2010年,该课题组就率先将双硒键引入到高分子主链当中,成功制备了两亲性的含双硒嵌段共聚物,并且研究了它的组装行为、药物载运能力以及氧化还原响应性。这类含双硒的纳米组装体,在外加低浓度的过氧化氢、低剂量的伽马射线辐照或者外加光敏剂及光照刺激下,就可以实现化学键的氧化,生成有机亚硒酸。同时实现负载药物的释放(如图1)。
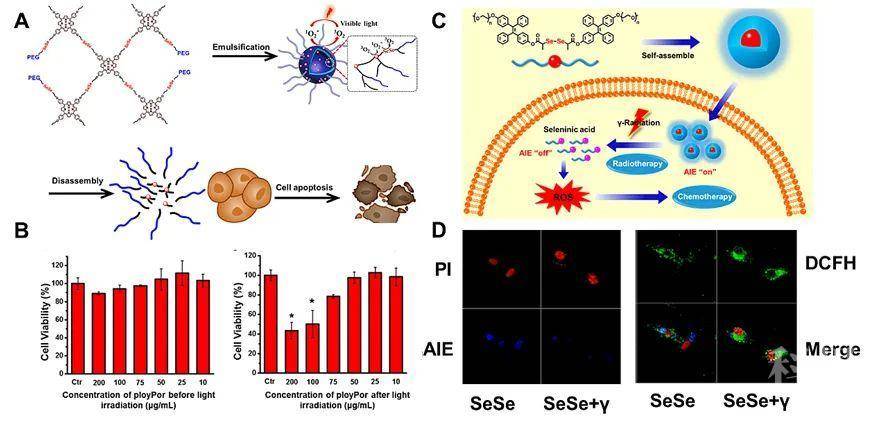
在之后的工作中,该课题组又进一步的证明,含双硒键的高分子组装体在氧化刺激后能够显著的提高癌细胞内活性氧物种(ROS)的浓度,进而诱导细胞的凋亡(图2)。在光动力治疗以及化疗等氧化治疗中,都具有一定的应用前景。
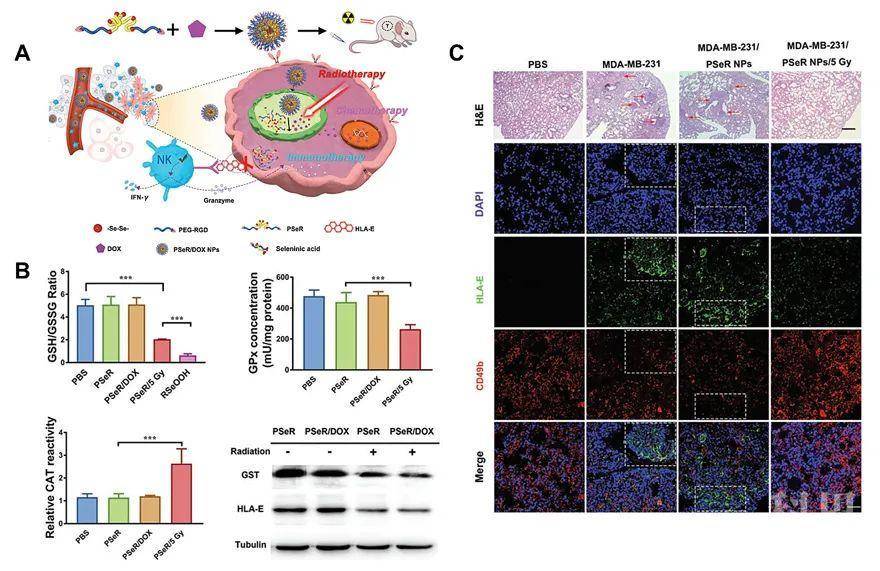
基于以上的研究,该课题组进一步的将含双硒键的高分子纳米材料应用到联合治疗的研究当中(图3)。包载化疗药物阿霉素所制备的药物递送载体,在伽马射线的诱导下,可以实现包载药物的释放,并且生成有机亚硒酸。而生成的有机亚硒酸,能够抑制乳腺癌细胞MDA-MB-231细胞表面HLA-E蛋白的表达,使得癌细胞更容易被人体的NK细胞所识别,并且吞噬。基于此,就可以实现化疗放疗以及免疫治疗的结合。

Chenxing Sun, Yizheng Tan, Huaping XuACS Materials Lett., 2020, DOI: 10.1021/acsmaterialslett.0c00272Publication Date: July 31, 2020Copyright © 2020 American Chemical Society
来源:gh_0320d0d498b4 ACS美国化学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyMjgzMzI0Ng==&mid=2247502340&idx=4&sn=98416c6210bf78691cbdb27153a323c2&chksm=e825f535df527c237f69d80543e8b0b5768d71e356b5d838807cde9b6b733a559b4d981d2d57&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn