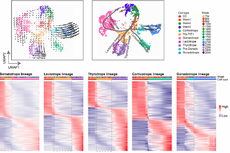
来源:BioArt
m6A (N6-methyladenosine) 是mRNA和lncRNA上丰度最高的修饰,从酵母到人类的多个物种中高度保守【1】。转录过程中,METTL3-METTL14复合物催化前体RNA上m6A的发生【2】;同时,m6A可以被FTO和ALKBH5调控去甲基化【3,4】,并能被YTH家族的蛋白所识别【1,5】。m6A参与了众多发育过程,m6A失调会引起包括癌症在内的多种疾病【6】。表观基因组的动态变化对于基因在发育和生理过程中的正确表达至关重要,转录过程是染色质动态调控的核心【7】。尽管m6A通过共转录产生,它对染色质的直接调节作用仍然所知甚少。
南方医科大学夏来新团队长期围绕RNA代谢和发育调控的关系,重点关注RNA加工在人类胚胎发育中的调控作用,旨在揭示RNA剪切和修饰在人类胚胎发育过程中的动态分布和基本功能,为人类出生缺陷和胎源性疾病的诊治、药物研发等提供理论依据及线索。
2019年夏来新课题组在Nature Cell Biology杂志上发表文章The RNA N6-methyladenosine modification landscape of human fetal tissues,利用优化的全转录组m6A测序方法,首次绘制了人类胚胎主要组织的m6A图谱,并发现METTL3在高CpG基因的转录起始区富集,这暗示m6A可能通过共转录的方式,直接调控相应基因的表观状态和转录(详见BioArt报道:NCB | 夏来新/何春江/钟梅合作组首次绘制人类胚胎全转录组m6A图谱并揭示发育调控特点)【8】。
2020年8月10日,Nature Genetics在线发表了夏来新与肖姗团队合作的题为 N6-Methyladenosine co-transcriptionally directs the demethylation of histone H3K9me2 的研究成果,研究首次发现m6A直接逆向调控抑制性组蛋白标记H3K9m2去甲基化的现象和机制,确立了RNA m6A修饰与组蛋白动态修饰之间的直接关系,揭示了环境和发育信号产生转录增强和记忆的新机制。

在该项研究中,为了筛选m6A共转录调控的表观修饰,夏来新团队建立了一个染色质修饰的报告系统,当报告基因转录本上发生了m6A修饰时,他们发现对应染色质上的抑制型组蛋白修饰标志物H3K9me2会被特异地去除,而其他的组蛋白修饰则变化不大。
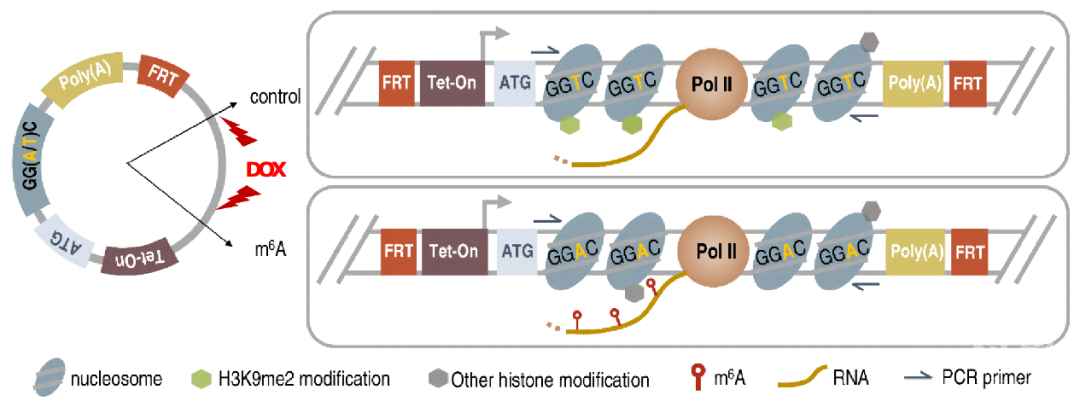 图1. 筛选转录过程中,响应m6A发生的表观修饰
图1. 筛选转录过程中,响应m6A发生的表观修饰他们继而在全基因组水平确认了m6A可以调控H3K9me2去甲基化,并发现m6A通过招募H3K9me2去甲基化酶KDM3B定位于染色质,进而控制对应区域的H3K9me2改变。深入的分析表明m6A识别蛋白YTHDC1和KDM3B存在相互作用,且YTHDC1可以招募KDM3B到m6A相关的区域,从而促进对应染色质区域H3K9me2的去甲基化。最后,研究者发现m6A能够促进H3K9me2调控的基因的转录。
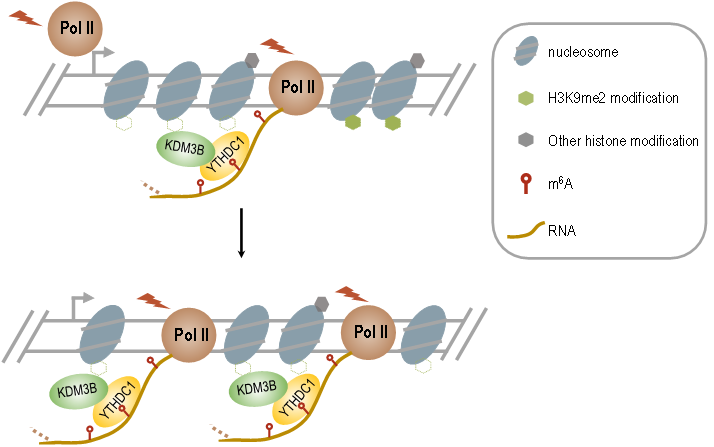 图2. m6A通过YTHDC1招募KDM3B调控H3K9me2去甲基化示意图
图2. m6A通过YTHDC1招募KDM3B调控H3K9me2去甲基化示意图综上所述,本研究揭示了RNA表观修饰信息通过共转录方式从RNA流动到染色质的新现象,建立了RNA修饰和组蛋白修饰之间相互作用的新机制,并为发育和表观记忆的研究提供了新视角,同时也为解答“RNA修饰在人类发育和相关疾病中的功能和调控”这一重大问题的研究提供了新线索。
参考文献
1. Dominissini, D. et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature 485, 201-6 (2012).
2. Liu, J. et al. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation. Nat Chem Biol 10, 93-5 (2014).来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652495215&idx=1&sn=0161125091cc08681e92135708dc945e&chksm=84e24edbb395c7cdbf59f39fcf686711a6aaac384d3a89fd25d600d2ee58b67560b470114532#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn