抗生素的滥用导致了细菌耐药性蔓延这一“世纪危机”。为了推动全社会合理使用抗生素,世界卫生组织(WHO)自2015年以来将每年11月的第三周确定为“世界提高抗生素认识周(World Antibiotic Awareness Week, WAAW)”。在2018年WAAW来临之际,中国科学院青岛生物能源与过程研究所发布了自主研发的国内外首台“临床单细胞拉曼耐药性快检仪”(Clinical Antimicrobial Resistance Ramanometry; CAMR-R)。该系统通过重水标记单细胞拉曼光谱,不需细胞扩增而直接测量临床病菌单细胞精度的耐药表型,全流程可在三小时内完成。因此,CAMR-R为临床合理使用抗生素提供了原创的解决方案。
抗生素的滥用导致细菌耐药性蔓延、“超级病菌”频发,以至于临床感染在不远的将来将“无药可用”。因此,临床上抗生素的合理使用是遏制耐药性传播的前提与关键,而前者则取决于临床耐药性快检技术的突破。
长期以来,临床上病原菌耐药性检测均基于“培养法”,其基本原理是,通过测量药物对病原菌细胞的生长抑制程度,来评价其耐药性。由于无法摆脱病菌的培养与纯化过程,这些方法通常耗时长达24~48 小时,难以满足临床快检现实需求,对于尚难培养或生长缓慢的病菌更是无能为力。核酸检测及全基因组测序等分子诊断技术,只适用于已知耐药基因的检测,对于未知基因或机制造成的耐药性则束手无策。而且它们仅能 “推断”耐药可能性,却无法“定量”检测耐药性。而临床上须基于“耐药表型”进行“耐药性确诊”,以可靠地指导用药。
在临床需求与技术现状矛盾日益突出的情势下,开发基于原理创新的耐药性快检方法学已成为国际共性挑战。例如,美国NIH 正悬赏二千万美元激励细菌耐药性快检技术开发,力求在2022年底前开发出临床耐药性快检技术。
青岛能源所单细胞中心前期发表了一系列论文,提出了“重水标记单细胞拉曼耐药性快检”与“单细胞拉曼药物应激条形码”的原理,引入了“最小代谢活性抑制浓度”(MIC-MA)的概念,发明了“单细胞光镊微液滴拉曼分选”(RAGE)、“单细胞流式拉曼分选”(RAMS)和“单细胞微液滴流式拉曼分选”(RADS)等技术及其核心器件。基于这些方法学革新,单细胞中心研制成功首台“临床单细胞拉曼耐药性快检仪”原理样机。
CAMR-R乃基于单细胞中心前期发明的重水拉曼组耐药性快检原理(D2O-Ramanometry)。当代谢活跃的细胞利用氘标记的水分子(重水)时,氘原子会参与细胞脂质合成过程,形成C-D 键并替换原有的C-H 键,且氘峰替换率(C-D Ratio)与细胞代谢活性线性相关。这一过程可通过单细胞拉曼光谱定量检测。因此,通过比较抗生素处理下的单细胞拉曼光谱之C-D Ratio 变化,可以在单个细胞精度检测抗生素作用下的代谢活性强弱,从而实现免培养的耐药性快检。由于所有的病原细胞维持生命活动都需要“喝水”,因此CAMR-R对于各种临床病原菌具有广谱的适用性。
迄今为止,MIC指数,即体外培养细菌24小时后能抑制培养基内病原菌生长的最低药物浓度,一直是微生物药敏试验、抗菌药效评价和临床抗菌方案制定的主流标准与主要依据之一。然而其测量不仅耗时耗力,且对难以实验室培养或生长缓慢的病菌无能为力。尤其关键的是,MIC只能从抑制细胞数目扩增这一角度反映与测量药效,却无法检测处于“NGMA”(Non-Growing but Metabolically Active)状态的病菌,即在药物作用下已经不再增殖但仍然具备代谢活性的存活细胞。这种状态的病菌在临床上十分常见,如果在抗菌治疗中成为漏网之鱼,将贻误病情,引起复发性感染,进而诱导耐药菌乃至“超级细菌”的频繁出现。因此根据MIC制定抗菌治疗方案有可能出现“不够快、不够准、不够狠”的情况。
为了克服MIC的核心缺陷,CAMR-R测量的是单细胞中心前期发表的“基于代谢活性的最低抑菌浓度”(“MIC-MA”指数)这一全新的抗菌药效指标,即药物作用后所有病菌细胞的代谢活性彻底被抑制的最低药物剂量。由于无需细胞培养、而且能够检测“NGMA”状态的病菌细胞,MIC-MA在实现“快、准、狠”的临床抗生素用药方面,与MIC相比,具有重要的特色与优势。
CAMR-R搭载了自主研发的“临床单细胞拉曼耐药性分析”智能信息系统。耐药性拉曼组自动采集软件(CAMR-RamLIS)可快速、准确、智能化地获取单细胞拉曼光谱信息。耐药性拉曼组分析软件(CAMR-RamEX)基于重水标记单细胞拉曼光谱,计算临床样品中病原细胞的耐药性及其异质性。与此同时,耐药性拉曼组数据库(CAMR-RamDB)通过多层次/易扩展的临床病原微生物单细胞拉曼数据库及拉曼组搜索引擎,支撑自动化、高通量的病原微生物种类识别。在此基础上,通过耦合独创的RAGE分选模块,快速分选出特定耐药性表型的细胞,并对接下游的单细胞基因组测序,从而深入考察耐药性的起源与传播机制。
此外,CAMR-R还携带了三个主要试剂盒:单细胞拉曼耐药性快检试剂盒服务于临床样品重水饲喂和重水标记单细胞拉曼光谱的测量;拉曼光镊液滴单细胞分选试剂盒包括RAGE芯片及其附件,用于特定耐药性细胞的快速分选;单细胞全基因组扩增试剂盒则服务于分选后单细胞的裂解与核酸扩增,从而与单细胞测序对接。
CAMR-R在检测原理、核心器件、分析软件和仪器系统等环节均具有自主知识产权。目前,在国家重大科学仪器研制项目的支持下,单细胞中心正开发高通量、自动化的CAMR-R系统,并与国内外的医疗机构和工业界合作,设计与示范针对肠球菌、金黄色葡萄球菌、克雷伯氏菌、不动杆菌、铜绿假单胞菌、大肠杆菌、结核分枝杆菌等临床主要威胁病原的耐药快检流程与医学检验设施,服务于国内外首个“临床单细胞耐药性监测网络”与“临床单细胞耐药性大数据系统”的建设。
论文信息:
1. Yifan Tao, Yun Wang, Shi Huang, Pengfei Zhu, Wei E. Huang, Junqi Ling, Jian Xu. Metabolic activity-based assessment of antimicrobial effects by D2O-labeled single-cell Raman microspectroscopy. Anal Chem, 2017, 89(7): 4108-15.
2. Xixian Wang, Lihui Ren, Yetian Su, Yuetong Ji, Yaoping Liu, Chunyu Li, Xunrong Li, Yi Zhang,Wei Wang, Qiang Hu, Danxiang Han, Jian Xu, Bo Ma. Raman-activated droplet sorting (RADS) for label-free high-throughput screening of microalgal single-cells. Anal Chem, 2017, 89(22):12569-77.
3. Lin Teng, Xian Wang, Xiaojun Wang, Honglei Gou, Lihui Ren, Tingting Wang, Yun Wang, Yuetong Ji, Wei E. Huang, Jian Xu. Label-free, rapid and quantitative phenotyping of stress response in E. coli via Ramanome. Sci Rep, 2016, 6:34359.
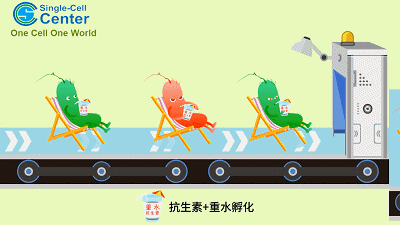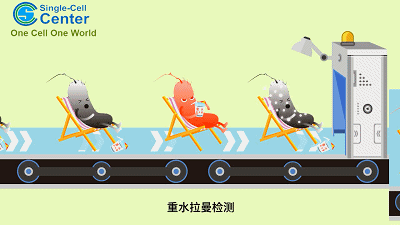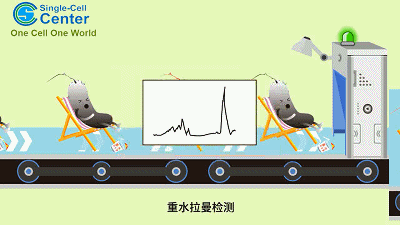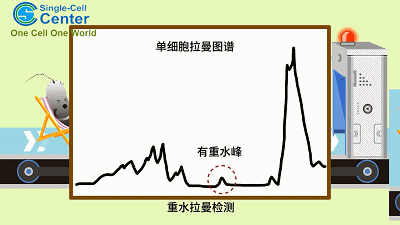
CAMR-R的工作原理示意图(动画)
内容来源:
来源:科协企业创新中心
原文链接:http://news.scei.org.cn/art.php?aid=638903
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

