来源:iPlants
CRISPR技术在近几年日新月异,已经成了精准农业和现代植物分子生物学研究必须的手段。其高效、特异、精确和安全性给现代农业发展、设计育种等带来革命性影响。但是对于目前多种不同的CRISPR方法,手段及其应用范围却缺乏系统性总结。
Plant Communication杂志于7月23日全文发表来自Florian Veillet等人带来的题为“Precision breeding made real with CRISPR: illustration through genetic resistance to pathogens”的综述。该综述非常详尽介绍了目前植物使用的多种CRISPR系统及其运用的PAM识别和相应的基因编辑范围。并且以植物病理学为例,总结了CRISPR已经取得的一些应用例子,并且展望了未来CRISPR将要取得的应用成果。另外作者对抗病基因R基因和易感基因S基因精准基因编辑工程提出了新的设想。
基因编辑技术主要是应用基于在靶点附近双链DNA错配修复过程产生的多种随机错误引入,插入或缺失从而达到基因编辑的效果。一个很关键的因素是需要找到稳定的DNA核酸酶进行特异性识别靶点,进行特异性切割,形成缺口,激活植物自身的DNA修复。而在所有的修复过程中,有模板的DNA修复其精确性极高,达不到引入突变的目的,只有DNA双链断裂修复是一种无模板的修复机制,容易引入插入或者删除突变。目前常用的Cas系统主要有2种,CRISPR-Cas9系统,CRISPR-Cas12(a和b)系统。CRISPR-Cas9系统应用最为广泛,主要来源2类II型嗜热链球菌适应性免疫系统,融合了DNA内切酶和单链向导RNA(sgRNA)可以识别特定的PAM模体。定位后在本地DNA行成R-loop结构引发SpCas9介导的DNA剪切,启动双链断裂修复,造成错配。Cas12a和Cas12b系统分别来源于毛螺菌和阿利克巴氏杆菌,主要应用了不同的核酸内切酶和识别靶点。他们剪切DNA的时候会产生4-5bp的粘性末端,在富含T的区域产生DNA双链断裂。这两者主要的区别是Cas9更多产生小范围插入/缺失,而Cas12产生大片段的缺失。
CRISPR介导的基因编辑是一个笼统概念,但是精确来说可以细分为3种不同的编辑策略。第一种是基于同源重组方法对植物引入DNA双链断裂修复导致插入/缺失。第二种方法与同源重组不同,是没有诱发DNA双链断裂修复的通过碱基编辑器进行单碱基定向精准编辑的方法。目前主要存在C-T或者A-G的单碱基修饰。通过融合不同的Cas9和sgRNA和脱氨基酶结构域形成PAM靶点识别差异。这种方式相较来说产生效果较慢,有持续的替换过程,也有一定的脱靶风险。
目前改进的方向是加上部分ssDNA结合结构域达到高精度替换,或者使用高效的尿嘧啶DNA糖基化酶抑制剂(UGI)降低非目标区编辑概率。第三种是原生编辑,原生编辑器直接通过一个逆转录酶和HNH受损的缺口酶Cas9(H840A)组成,利用pegRNA导向,把特定DNA链替换成靶点特定DNA链,实现了完整的“寻找-替换”策略。目前这种策略在植物中运用较少,仍然需要更多转化事件来独立评估其安全性。
除了讨论具体的CRISPR技术,作者也讨论了基于这些技术在植物抗病领域的应用。包括通过多种方式对核结合富亮氨酸重复蛋白(NLR)进行修饰以增强对特定效应器或者更广谱病原菌的识别方式。作者也对未来抗病领域运用CRISPR基因编辑技术改良作物品种需要防范的风险和前景做了深入探讨,既用了在稻瘟病、小麦叶片铁锈病单碱基编辑的成功例子,也提出未来在植物抗病机理研究上有了更为深入的理解后利用原生编辑、碱基编辑及获得性抗性突变体筛选的方法,在不影响植物其他农艺性状的条件下进行设计育种。作者认为,目前的DNA递送方式(农杆菌转化、基因枪等)都有许多限制和副产物效应,如果躲避或者发展新的DNA递送方式才能真正释放CRISPR技术的全部潜力。
感谢此新闻稿的作者陈可博士对“Mol Plant植物科学”公众号的支持!
陈可,毕业于中科院上海植生所。目前沙特阿卜杜拉国王科技大学博士后,主要从事植物抗逆蛋白结构及功能相关研究,感兴趣研究方向为RNA修饰在植物发育调控过程作用。曾以第一作者发表高水平SCI论文数篇。
这篇综述是一篇非常好的CRISPR技术的入门介绍,下文是全文的翻译,译者亦非专攻基因编辑领域,难免有纰漏,欢迎各位读者批评指正!
摘要自从发现原核生物的免疫系统及其在真核生物基因编辑的作用,CRISPR技术改变了植物研究和精准农业。CRISPR的工具箱能有效产生植物的抗病性,增加农业的活力和减少化学药物的使用。这些对于现代农业和公众健康都带来深远影响。在这个综述,我们提供了大量CRISPR技术最近突破。我们展现了如何每一个CRISPR工具可以作为农业生产的运用。也为可持续农业提供新的工具箱。short summaryCRISPR介导的精准农业提供给研究者和育种工作者多种编辑基因组的可能。运用这些基因编辑工具可以提高植物病原菌互作促进抗病作物的可持续农业发展。// 引言气候的变化加剧了不断增长的人口和食物的矛盾。全球约8亿人,特别是亚洲和非洲,会遭受饥饿和营养不良的侵蚀。如今的农业科学研究局限于很小范围的植物品种,一些是地理位置的关系,远离他们的驯化地区。高密度劳动和时间成本需要花在植物适应新的环境和食物的有效性。植物基因组工程的发展打开了精准农业新的道路,既包括提高精英物种的改良和新野生种的分子驯化。
植物病原体,包括细菌,真菌和病毒,持续的造成经济损失和食品安全威胁。病原体依赖多种策略绕过植物免疫。举例说明,他们产生效应子作为分子武器对植物细胞内外产生作用,针对多种不同的宿主蛋白,影响细胞过程,促进感染。植物依赖一套非常先进的免疫手段保护自身免遭病原体侵染。关键的是一大批识别病原菌特定蛋白的“军火库”受体,识别宿主信号介导的侵染模式。侵染模式受体主要属于2个大类:细胞表面受体包括类受体蛋白和类受体激酶和细胞内受体(大量属于核酸结合富亮氨酸重复蛋白)。当这些NLR识别细胞内效应子,类受体蛋白和类受体激酶感知微生物相关的分子模式(MAMPs)和宿主细胞由于抵抗病原体攻击导致的损伤产生的损伤相关分子模式(DAMPs)细胞外效应子。
大多数抗病基因R基因是编码富亮氨酸重复蛋白的免疫受体。另一个植物抗病成功的策略是依赖于多种植物易感基因S基因的突变。基于此,病原体无法完成浸染的循环过程,最终导致植物抗病性。当然,传统抗性育种可以取得很大的成功,但是他可能会被多种不断进化的病原体快速绕过由于单个R基因富裕的抗性。因此,对于R基因和S基因的精准基因编辑工程对于培育具有遗传抗性的农作物非常重要,而且这些方法可以限制化学农药等对环境的冲击。跨品种的复制突变也可以规避与经典育种相关的连带关系。
在过去的几年内,基因编辑工具随着RNA介导的核酸酶快速发展。直到现在,基因编辑广泛使用于受经典CRISPR-Cas9系统剪切的目标片段的双链DNA错配修复产生的错义突变位点。比如,这种策略通过敲除抗霉菌(Mlo)的S基因,获得了抗白粉病的番茄,而水稻稻瘟病抗性的增加由于转录因子OsERF922的功能丧失。然而,许多的性状是由于单个或者多个核苷酸替换,特别是植物病原体的互作,在共同进化中发挥双重作用。一方面选择压力既有利于病原体效应器的突变以逃避植物的识别,但也有免疫受体的突变会恢复对病原体的感知能力。因此,基因组编辑工具对于广谱抗性的获得性功能突变介导精确和预测的突变具有非常高的价值。特别值得关注的是CRISPR介导的类似自然等位基因赋予病原体的抗性以及在植物界定向进化,以产生自然遗传多样性中不存在的新基因变体。在本篇综述中,我们将把核苷酸变化和小的缺失等定向基因组改变称为精准育种。这个过程可以涉及到转基因技术,但所产生的植物没有转基因。
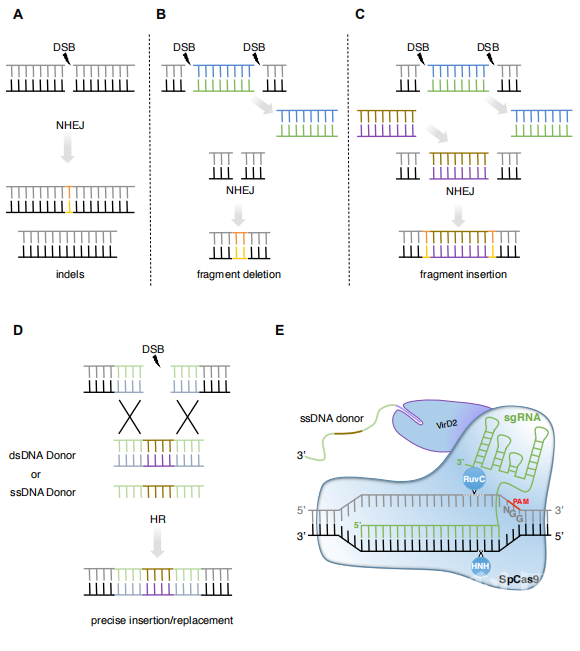 CRISPR-Cas systems used for genome editing in plants.
CRISPR-Cas systems used for genome editing in plants.在这个综述里,我们关注到最新的CRISPR技术的发展及应用,包括最新的“寻找-替换”编辑技术。我们会看到多种调整扩大了这些CRISPR工具的靶向范围‘精度和效率,同时如何提供互补优势和缺点根据我们的目标设定而进行结果改变。这些精确的多功能基因组编辑工具在植物中的快速采用和改进,为生物技术和可持续发展开辟了新的途径。
在这部分,我们会重点关注基因组编辑策略,即那些导致植物基因组DNA稳定修饰的方法,并通过不同的递送策略造成非转基因植物,这些策略会在下文得到广泛的描述。我们将不会讨论另一个重要的CRISPR技术(比如Cas13)在RNA编辑的应用。更多的信息可以在以下一些综述中获取。//CRISPR-Cas9 系统CRISPR-Cas9系统,最初来源是2类II型嗜热链球菌适应性免疫系统,由DNA内切酶SpCas9(1368氨基酸)和可定向的单链向导RNA (sgRNA)组成的双组分复合物该复合物由一个crRNA和一个反式激活crRNA (tracrRNA)人工融合而成。sgRNA 由80bp脚手架序列介导结合到Cas9,还有20bp目标序列在他的5‘段,叫间隔区序列。主要是复合体和DNA目标区的特异性识别。sgRNA和SpCas9的结合可以触发SpCas9从无活性状态转变为DNA探查状态,找到目标5‘NGG临近基团(PAM)。多种识别PAM的天然的和工程化的Cas9变体也被广泛使用。识别一个稳定的PAM模体可以导致临近的DNA快速定位,然后本地DNA融化,RNA链入侵(形成一个R-loop 结构)。在种子区域(距离PAM10-12核苷酸)间隔区序列和目标DNA区需要SpCas9介导的DNA剪切,然而在非靶点的错配也会发生,可能导致引入不确定的脱靶活性。当一个完美设计的间隔区序列能有效避开脱靶活性,一些Cas9变体通过蛋白质工程展现出高特异性。逐渐的碱基配对触发SpCas9构象变化到一个活性位点,最终通过其HNH和RuvC核酸酶域的协同活性导致DNA裂解。虽然SpCas9被认为只能在PAM上游约3-bp处产生钝端双链DNA断裂(DSB),但最近的研究结果表明,SpCas9核酸酶的活性会导致钝端和交错端,这可能是由于RuvC切割的灵活性。目前,CRISPR-SpCas9系统已在众多物种中得到常规应用,可视为植物基因组编辑的黄金工具。//CRISPR-Cas12系统第二种重要的基因编辑技术,class2V-A类CRISPR-Cas12a 系统,也称CRISPR-Cpf-1,展现出相关的替代和独特的特征。Cas12a酶(1200-1500氨基酸),识别富含T的5‘-TTTN-3端PAM上游靶基因序列。他们与43bp的crRNA和单独依赖RuvC-like结构域同时剪切DNA双链剪切出交错的4-5bp区域。Cas12a来源于毛螺菌,多种植物种已经使用。相较于Cas9系统,他们展现出更高的特异性,更少的脱靶现象。
最近建立的V-B类CRISPR-Cas12b系统利用一个比Cas9和Cas12a更小的Cas12b核酸酶(1100氨基酸)类似于Cas12a,Cas12b倾向于富含T的PAM区和诱导RuvC介导的DNA双链断裂修复。Cas12b来源于阿利克巴氏杆菌,在动物细胞中高特异性核酸酶剪切效率。在水稻的基因组工程中,利用5‘-VTTV-3’PAM序列被报道有效。另外,在4倍体棉花AacCas12b也成功运用。在45摄氏度编辑效率最好,而且没有检测到脱靶现象。尽管有效,但是更多的关于Cas12b和Cas9和Cas12a检测证据仍然需要.//不断进化的CRISPR-Cas系统:基因敲除以外的作用以上介绍的三种CRISPR-Cas系统组成了多种多样的基因编辑工具。至此,绝大部分基因编辑在植物中的运用都是关注于单个或多个基因的敲除。这是由于在高等植物的体细胞中,以易出错的非同源末端连接(NHEJ)机制修复CRISPR-Cas介导的DSBs为主。与同源重组(HR)相反,NHEJ机制介导DSB修复,而不需要同源模板,这是一种在减数分裂过程中负责同源染色体之间交叉的内源性DNA修复机制。虽然经典的NHEJ(C-NHEJ)途径似乎主要是无错误的,但替代的NHEJ(Alt-NHEJ)却在CRISPR诱导的双链断裂修复起着关键的错误。这种DNA修复导致了在剪切位点随机的小的插入或删除,从而造成移码突变最终导致编码区功能性丧失位点。在启动子区,通过删除顺式调控元件也可以导致转录水平调控改变。
 NHEJ- and HR-mediated DNA mutations after CRISPR cleavageCRISPR-Cas9系统有趣的特征是其剪切功能可以与位点识别脱离开。这个可以用来重构系统,带特定的酶结构域至特定的位点。事实上,RuvC或HNH催化域被D10A或H840A替换失活后,产生的缺口酶Cas9(nCas9)只能分别切割靶向链和非靶向链,而引入这两种突变会产生dead Cas9(dCas9)。类似于dCas12a和dCas12b,但缺口酶Cas12蛋白尚未报道。然而,事实上,Cas12酶的DNA裂解是依次由单一的RuvC类核酸酶域介导的,这可能会阻止这种缺口酶 Cas12的发展。这些突变的的Cas蛋白保持其DNA结合特性,从而允许有针对性的应用,如通过招募DNA甲基化机制或转录调节剂,分别进行表观基因组编辑或转录调节。特别值得关注的是,将特异性替换基因组序列中核苷酸的酶域,从而直接编辑基因序列的可能性。在接下来的章节中,我们将主要关注这种最近开发的CRISPR系统,这些系统支持精确和可预测的靶向DNA突变,以赋予新的性状。//精准编辑:工具的升级?正如许多农业性状受到单碱基多态性,引入特定的插入/删除可以预测性的出现新的农业性状。比如,目标区间可能引入非同义突变引起氨基酸变化。单碱基替换可以造成提前终止或剪切变化。下一个小部分,我们会综述目前CRISPR技术的精准编辑的应用。
NHEJ- and HR-mediated DNA mutations after CRISPR cleavageCRISPR-Cas9系统有趣的特征是其剪切功能可以与位点识别脱离开。这个可以用来重构系统,带特定的酶结构域至特定的位点。事实上,RuvC或HNH催化域被D10A或H840A替换失活后,产生的缺口酶Cas9(nCas9)只能分别切割靶向链和非靶向链,而引入这两种突变会产生dead Cas9(dCas9)。类似于dCas12a和dCas12b,但缺口酶Cas12蛋白尚未报道。然而,事实上,Cas12酶的DNA裂解是依次由单一的RuvC类核酸酶域介导的,这可能会阻止这种缺口酶 Cas12的发展。这些突变的的Cas蛋白保持其DNA结合特性,从而允许有针对性的应用,如通过招募DNA甲基化机制或转录调节剂,分别进行表观基因组编辑或转录调节。特别值得关注的是,将特异性替换基因组序列中核苷酸的酶域,从而直接编辑基因序列的可能性。在接下来的章节中,我们将主要关注这种最近开发的CRISPR系统,这些系统支持精确和可预测的靶向DNA突变,以赋予新的性状。//精准编辑:工具的升级?正如许多农业性状受到单碱基多态性,引入特定的插入/删除可以预测性的出现新的农业性状。比如,目标区间可能引入非同义突变引起氨基酸变化。单碱基替换可以造成提前终止或剪切变化。下一个小部分,我们会综述目前CRISPR技术的精准编辑的应用。//CRISPR通过NHEJ调控基因尽管Cas9系统剪切引起的NHEJ介导的双链断裂修复最初被认为会造成随机突变,但是目前的证据显示这种结果是可以预测的。一些网络工具通过算法学习最近被运用来预测人类细胞修复的结果,也表明通过NHEJ方法找到可预测的突变的人工选择是可能的。这些可以预测在编码区和调控区NHEJ介导的DNA双链断裂修复工具在植物中会引起巨大的兴趣。当然,Cas9造成小的插入/缺失,而Cas12a和Cas12b产生大片段缺失。这些差异是由于Cas12剪切或者核酸酶结合时间破坏DNA的程度,仍然不清楚。除了他们的机制,相较于Cas9,Cas12更多用来移除大片段编码区或者调控模体。
通过这两种sgRNA方法,大的DNA片段可以被删除,可以达到部分或者完全缺失某些基因。NHEJ介导的DSB修复方法也可用于使用无同源末端的dsDNA或ssDNA供体进行定向DNA插入。然而,这种技术在5′和3′连接处引入了小的缺角。这个主要的缺点可以通过一种策略来解决,即通过在侧翼内含子中创建DSB来替换整个外显子,从而将NHEJ相关的内含子序列限制在非编码内含子序列上。这种NHEJ介导的外显子替换策略已经成功地应用于水稻OsEPSPS基因,其中两个氨基酸变化的引入使水稻产生了草甘膦抗性。
尽管这些NHEJ介导的基因编辑策略已经被证实提供了有效和可靠的基因敲除,但是在剪切点不可预测的结果仍然限制他们的精准编辑。这一缺点在生殖生长的作物中尤其重要,因为目标位点的理想或不理想突变不能通过有性繁殖分离。因此,通过与NHEJ无关的途径,可预测和精确地引入点突变或基因突变,具有特别的意义。//CRISPR介导的基因靶向CRISPR介导的基因靶向是依赖于同源重组技术可以用于许多真核生物基因组的核苷酸替换和精准插入或者删除。尽管基因组工程运用很多,但是对于植物体细胞却非常低效率。如何输送足够数量的供体模板到靶点附近仍然具有很大挑战性,这些都极大限制了运用同源重组在高等植物物种的发展。大量地CRISPR介导的同源重组研究是基于除草剂耐受性作为识别转基因事件的成功与否。目前对于植物同源重组技术已经有了很大的提高。特别值得关注的是使用工程化的植物病毒复制子系统,它利用滚动循环复制将大量的DNA修复模板输送到植物细胞核中。
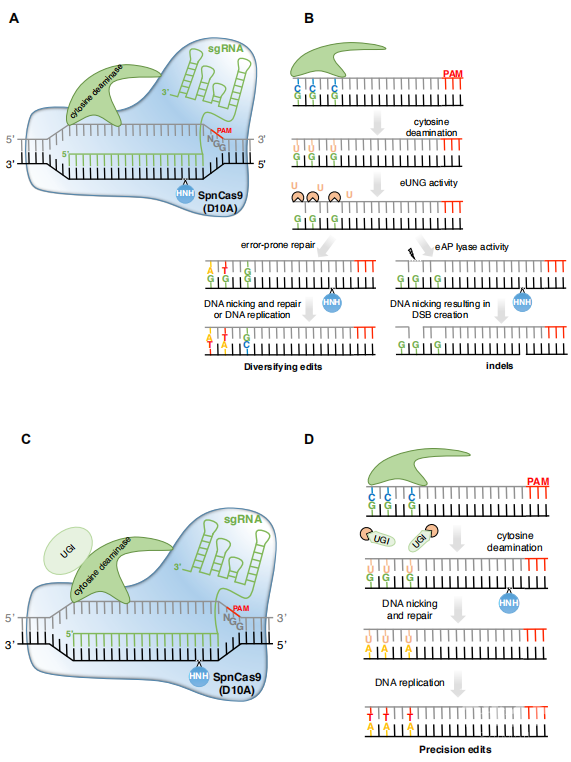
CRISPR-Cas9 系统植物病毒复制子策略已成功应用于番茄、马铃薯、木薯、小麦和水稻的大面积插入和/或点突变。另一个有趣的方法是使用Cas12a而不是Cas9来诱导DNA双链断裂。因为Cas12a切割PAM区的非种子区域末端,允许NHEJ介导的插入突变后的多种DNA剪切,而且产生粘性末端,同源重组方式喜欢和需要粘性末端。基于这些事实,CRISPR-Cas12a 同源重组系统成功运用到水稻单碱基插入和突变中。这种方法很快也被运用于产生无转基因的耐盐番茄,单单造成一个SlHKT1;2的N217D氨基酸改变。虽然病毒复制子系统允许在植物中传递更多的供体模板,但为了在空间和时间上将CRISPR元件和修复模板带到断裂部位,如在动物中观察到的那样,同源重组仍然需要一些改进。这些策略比如将Cas9和农杆菌VirD2松弛酶融合运用到水稻,这是个ssT-DNA转座和整合的关键元件。CRISPR-Cas9-VirD2系统很可能通过在Cas9诱导的DNA双链断裂附近传递ssDNA修复模板来促进同源重组的发展。这使得OsALS和OsCCD7基因引入点突变,分别赋予除草剂抗性重塑植物结构,并在OsHDT的C端插入HA表位。总的来说,这些最近的发展给予了精准基因组编辑的可能性,尽管未来如何增加CRISPR介导的同源重组的效率和多种植物的运用仍然是未来的焦点。//CRISPR-介导的碱基编辑与同源重组基因修正相反,CRISPR-介导的碱基编辑是依赖供体模板而没有诱发DNA双链断裂方法。通过融合胞嘧啶碱基编辑器(CBEs)和腺嘌呤碱基编辑器(ABEs)与一个催化活性丧失的Cas9和一个脱氨基酶活结构域。在形成CRISPR的R-loop结构一小部分非靶点的ssDNA暴露可以作为脱氨基的底物。CBE催化目标区脱氨基的胞嘧啶变成尿嘧啶。这样可以引发没有错误的碱基精确修复(BER)过程。导致(C-T,C-G和C-A)尽管这个插入产物是一个持续的过程。尽管多种的编辑器都很重要,但是可预测的精准氨基酸编辑更为重要。将尿嘧啶DNA糖基化酶抑制剂(UGI)添加到CBE架构中,阻断BER途径,已经开发出一种解决方案,专门获得C-to-T转换,此方法得到的副产物水平普遍较低。通过ABEs对腺嘌呤的脱氨不需要使用烷基腺嘌呤DNA糖基化酶抑制剂,因为肌苷中间体的BER在DNA中是低效的。因此,ABEs创造了高效的A到G的转换,副产物的水平非常低。虽然第一个BEs藏有一个dead Cas9(dCas9),通过使用具有受损RuvC域(D10A)的nCas9,促进长片段BER使用编辑链作为模型,将编辑(s)纳入到非去离子链强烈改善。目前由于缺乏nCas12,Cas12酶在碱基编辑应用中的使用仍然有限。CBEs和ABEs在动物中开发后不久,就迅速在一些植物物种中得到应用。据报道,两种最常用的胞嘧啶脱氨酶,七鳃鳗的PmCDA1和大鼠的rAPOBEC1(两者均不含UGI),不仅在拟南芥、番茄和马铃薯中产生C到T的转变,而且还产生C到G和C到A的转变。对于有高精度要求的产物预测性,UGI结构域可以加入CBE结构中,可以产生高速度的C-T转变而低概率的其他位点突变。正如动物中观察到的,ABE产生的A到G转变在植物中也是非常慢的替换。这些碱基编辑器可以产生植物新的农艺性状,包括抗病性。最近,双编辑器C-T和A-G在同一个编辑事件增加了目标基因的修饰产出。多种去氨基酶可以被sgRNA-蛋白互作招募到靶点催化特定的产物。
 CRISPR-mediated prime editing
CRISPR-mediated prime editing尽管碱基编辑器是一个很有前景的技术,但是早期的CBE和ABE都有一些缺点。首先,他们的靶点是局限于合适的PAM下游的靶点,只能在5‘末端间隔区。许多的工作利用天然的Cas9同源基因识别不同的PAM, 如金黄色葡萄球菌或者链球菌Cas9。或者对SpCas9进行工程改造,使得他们可以识别更多的PAM,延伸碱基编辑器的目标。特别是最近动物细胞识别新的无-G PAM区域,或者NRN区域。当我们使用DNA递送的方式时,我们需要应对sgRNA自我靶向的问题,增加了在间隔区引入脱靶的风险。第二点,基因编辑器会从模块化产出中收益。人APOBEC3A胞嘧啶脱氨酶在水稻、小麦和马铃薯中的17-bp编辑窗口内介导碱基转化,从而提高了靶向位点的饱和诱变潜力。为了增加CBE的ssDNA亲和性,zhang等在nCas9和脱氨酶中间融合了一个ssDNA结合结构域,导致了高效胞嘧啶编辑。与此相反,CBE限制编辑窗口来躲避副产物突变,从而达到高精确度替换。第三点,在水稻中CBE锚定rAPOBEC1脱氨基酶融合了UGI展现了持续独立于sgRNA-Cas9脱靶C-T突变,并没有造成非必要效应。这些单核苷酸变异特别是在基因区遇到,其中单链DNA是由于活跃的转录产生的。为了最大限度地减少这些CBE介导的、在动物中也观察到的不可预测的全基因组脱靶突变,已经在动物中开发了工程化的CBE,但仍需在植物中进行验证。
相较于sgRNA文库,碱基编辑工具箱通过在整个基因或特定的序列编码域中产生许多有针对性的突变,允许识别与农艺性状相关的新的关键氨基酸,从而为推动植物CRISPR指导的蛋白质进化提供了巨大的希望。到目前为止,单氨基酸在OsALS1和OsACC基因替换对于除草剂抗性已有报道,这毫无疑问对于抗病作物,和其他环境友好的作物培育策略带来巨大潜力。
包括CBE和ABE在内的多种碱基编辑器工具可以为植物发展新的表型服务,包括定向进化。但是考虑到现在碱基编辑的限制范围,每一种应用都需要合适的谨慎的选择最好的工具,限制了基础编辑的广泛采用,也凸显了对更多通用性的需求。// CRISPR介导的原生编辑尽管CRISPR工具箱有了相当大的扩展,但精确的、可预测的靶向转录、插入和缺失仍然难以引入真核生物基因组。最近,一种直接介导将新的遗传信息写入特定位点的突破性新技术在哺乳动物细胞中得以实现,为精准的基因组编辑带来了新的可能性。这种 "搜索和替换 "技术被称为 "原生编辑",不需要依赖DNA双链断裂或者DNA供体模板可以介导有针对性的插入、删除,以及任何单一或多重替换。原生编辑器是由一个逆转录酶(RT)与一个HNH域受损的缺口酶Cas9(H840A)组成的。这是一个叫pegRNA的sgRNA导向,由一系列经典的sgRNA组成的包括引物结合序列(PBS)和一个逆转录模板组成的多态性。非靶向链的位点特异性ssDNA断裂和PBS对缺口链的游离3'端的退火导致逆转录模板的逆转录的引物。这导致在游离的3'端聚合一个与RT模板互补的编辑ssDNA,这被称为3'编辑瓣。之后生物DNA修复机制会在5‘瓣剪切3’瓣连接。从而在编辑后的链和未修饰的链之间产生一个杂双链,然后将其解析为永久稳定所需的编辑后的链。与用于碱基编辑的策略类似,剪接非编辑链通过有利于编辑的稳定结合,大幅提高了原生编辑的效率。
虽然在哺乳动物细胞中成功地开发出高度通用和精确的原生编辑带来了巨大的希望,但植物原生编辑器(PPEs)的实施也可以为改善粮食作物做出贡献。在动物的原生编辑器应用几个月后,几个课题组已经改编和采用了这种编辑方法在作物。三个不同的植物原生编辑器也检测了他们的编辑效率:PPE2,PPe3,PPE3b。当PPE2只有nCas9-RT和pegRNA组成时,PPE3目标是通过利用额外的sgRNA靶向位点上游或者下游剪接非编辑链促进修复。PPE3b同样由非编辑链剪接方式组成,但是额外的sgRNA靶向新的位点,攻击只是3‘瓣形成后因此阻止了导致更高插入删除效率的DNA双链断裂。PPE2、PPE3和PPE3b系统有Moloney鼠白血病病毒(MLV)逆转录酶,在水稻和小麦原生质体中,以及在农杆菌介导的转化水稻植株中都有类似的编辑效率。这表明,剪接非编辑链不一定能提高植物的原生编辑效率。植物原生编辑器展示了可以引入所有类型的单碱基或者多碱基突变。正如在哺乳动物细胞中观察到的那样,副产物主要是pegRNA支架插入,这可能源于逆转录酶的广泛活性,以及由于两条链的配对剪接而导致的大的缺失。总的来说,水稻和小麦的编辑效率在低百分比范围内,尽管分别21.8%31.3%的农杆菌介导转化再生的水稻植株中检测到精确的6-bp缺失和单个A-to-T突变。CRISPR介导的原生编辑在植物中的概念性运用打开了令人振奋。尽管这种新工具的广泛使用还需要克服一些挑战。提高质粒编辑效率是一个重要的轨道,特别是对于多倍体和/或植物繁殖的物种。因为在目标位点之间观察到了质粒编辑活性的高变异性,"复制和替换 "机制可能会被增强,以促进可靠的结果率。原生编辑架构应优化为最大限度地提高CRISPR元件的表达水平,和使用不同的逆转录酶,可能在植物细胞中更有效是特别的兴趣,以及优化逆转录酶活性的温度条件。一些pegRNA和sgRNA做为新的靶点也被成功测试和推荐。虽然原生编辑器可以容纳长的逆转录模板,并且比碱基编辑器对PAM限制少很多,但是使用Cas9变体与放宽的PAM识别可能是相关的,以定位编辑在从ssDNA切割位点的有利位置。最后,虽然原生编辑似乎在动物的推测脱靶位点诱导出比Cas9更低的脱靶编辑。但需要仔细评估原生编辑器的基因组范围内的脱靶活性,以评估逆转录引起的独立于CRISPR的编辑能力。//精准育种,一个选择新的工具箱的事件CRISPR-介导的同源重组,碱基编辑,原生编辑组成了精准编辑的工具箱,共同地提供了几乎可以编辑所有的长度和位点的靶点机会。当DNA长度需要精确插入或者删除,同源重组的方法是最合适的,而原生编辑效率随着增加的插入和删除的长度效率降低。然而,小的插入和删除对于原生编辑和同源重组策略都适用。
碱基编辑似乎普遍比目前的原生编辑更有效地进行碱基替换。因此,当旁观者突变可以接受时,应使用早期的碱基编辑,而当旁观者编辑不可取时,应倾向于使用编辑窗口较窄的新碱基编辑。然而,当碱基编辑不能产生所需结果时(如大多数反转或多碱基替换),原生编辑提供了更多的灵活性。对于需要定向局部随机诱变的应用,如蛋白质的定向进化,碱基编辑仍然是最合适的工具。然而,原生编辑可能被修改为通过低保真逆转录酶在目标位点随机插入多态性,从而提供另一个遗传变异性的来源。由于原生编辑只是处于发展的早期阶段,我们希望未来的改进将是大大提高了他们的效率,扩大他们的目标范围。//基于CRIPSR的病原菌抗性工程有趣的是,CRISPR-Cas可以直接用于靶向病原菌基因组,主要是病毒基因组。这对于DNA/RNA病毒都适用,但是需要表达特定的CRISPR-Cas酶和特定的gRNA,类似于RNAi策略。因此,这超出了精准育种的范围,但读者可以在最近的综述中找到关于这些策略的细节,以及它们可能的注意事项。现在,通过CRISPR技术应用精确育种,改善精确和/或准时序列变异所赋予的性状成为可能,为发展可持续农业的抗基因作物提供了非凡的机会。CRISPR的应用主要集中在产生功能缺失的等位基因上,在生产抗病原体植物方面取得了一些成功。然而,植物与微生物之间的相互作用是一个漫长的共同进化的结果,涉及到与几个关键角色的复杂分子对话。因此,CRISPR介导的功能增益突变似乎与开发具有改进的抗病原体的作物高度相关。在下文中,我们回顾了目前对CRISPR介导的病原体抗性精确编辑的认识,并提供了现在CRISPR所能达到的有趣的线索。//免疫受体工程在过去的几年关于核结合富亮氨酸重复蛋白(NLR)的分子机制,结构核进化研究取得了巨大的成就。这些使得新技术通过诱导免疫反应提高NLR的能力可以实现,而且拓展了病原菌识别甚至创造新的位点。然而, 现在只有非常少的例子可以说明。另外, 现在的NLR工程策略依赖于要么测试瞬时转化修饰后的NLR基因或者稳定转化易感品种。利用CRISPR对NLR基因改造仍然未见报道。然而,通过CRISPR产生新的抗病性的优良品种是一个值得注意的新技术。快速提高的和发展的CRISPR工具是往下发展新技术的途径。
其中一个NLR工程方法依赖于通过编辑他们的受体调控残基提高激活潜力也提高他们识别的图谱。他的策略已被用于小麦白粉病抗性基因Pm3,它形成了介导禾本科布氏白粉菌分离物特异性识别的等位基因系列。通过比较Pm3的几个等位基因,它们表现出宽的 (a和b等位基因) 或窄的 (f等位基因) 抗性谱,Stirnweis等人确定了NB域中的两个多态性,它们分别负责增强信号传导活性和扩展抗性谱。
CRISPR介导的这种调控残基在NLRs的原生编辑可以创造人工'触发快乐'变体与拓宽的抗性谱直接在精英栽培品种。然而,NLRs的错误调控会带来多向性表型的风险,在这类方法中必须考虑到这种潜在的权衡现象。
另外,NLRs的识别范围可以通过改变负责效应器识别特异性的残基来拓宽或修改。在等位NLRs系列中,不同的等位基因表现出不同的病原体识别特异性(如大麦MLA、小麦Pm3、亚麻L或水稻Pi-2/Piz-t/Pi50),LRR域在效应子识别特异性中起着关键作用。在这些情况下,CRISPR技术的一个有吸引力的应用是通过突变LRR域中决定特异性的特定残基或序列,提供一个具有识别特异性已经存在于其他品种中的精英栽培品种。这样就可以根据病原体种群调整精英栽培品种的病原体识别特异性,而不需要经过繁琐的杂交和选择步骤。历史上亚麻NLRs L2、L6和L10的例子说明了这种方法的潜力,LRR域的交换使亚麻锈病识别特异性发生了变化。
通过对LRR域中特定残基的定向诱变,在知识指导下进行全新的识别特异性工程,目前还不可能实现。为此,我们需要更好地洞察NLR激活的分子机制,以及对介导效应器识别和特异性的LRR残基的具体和精确的知识。对等位基因多样性的调查以及LRR域的结构建模可能有助于识别可能参与效应器结合的多态表面残基。因此,填补这一知识空白是当务之急。事实上,就目前而言,通过LRR域中的突变产生的新的识别特异性只是通过随机突变的方法。例如,在赋予马铃薯病毒X(PVX)抗性的马铃薯NLR Rx中,发现了LRR域的点突变,扩展了识别谱。在高通量筛选系统中通过随机诱变方法发现的CRISPR介导的这种突变,有望创造新的或扩大的抗性。
另一种基于基因组编辑技术的策略是重新激活农艺优良品种中的假基因NLR基因。这将允许抗性的 "复活",而不需要繁琐的克隆和互补步骤。在许多国家,也不需要与转基因生物监管有关的问题。这种策略与NLR相关,其中功能的损失是由于有限数量的多态性,可以通过碱基编辑来 "修复"。这样的策略已被测试使用转录激活剂样效应核酸酶(TALEN)编辑小麦Lr21基因,它提供种族特异性抗小麦叶片铁锈病。无活性的lr21Ψ等位基因与Lr21的不同之处在于三个非同义多态性和一个破坏ORF的单碱基缺失。通过编辑单碱基缺失,Luo等人恢复了lr21ΨORF,但这并没有重建一个功能性抗性基因。CRISPR介导的碱基编辑已成功用于水稻中重新激活RLK编码基因Pi-d2,该基因赋予水稻对赤霉病的抗性。比较基因组学、群体基因组学和NLRs的种内检测(如通过抗性基因富集测序)等领域的快速进展,使NLR基因中与疾病抗性或易感性相关的多态性的鉴定成为可能,这将有利于这些NLR工程方法。
一些NLR含有于病原体效应器相互作用的非常规结构域(ID)。对这些结构域进行精准的工程设计可以导致增强或者获得更广泛的抗性。最近,2个IDs与他们的识别的效应器三维结构已被解析,使得这种用于与效应器精确识别鉴定成为可能。这在Pikp-1识别稻瘟病菌效应子AVR-PikD的情况下,可以对ID进行结构性识别编辑,从而识别以前未识别的效应子等位基因AVR-PikE。这种特异性的获得在体外和本氏烟草的瞬时转化中得到了证明。该突变是否导致同源水稻/马格纳波特氏菌系统的扩展抗性仍有待证明。在真正的宿主植物中的CRISPR介导的碱基编辑策略将是这类实验的真正资产。尽管这些方法非常强大,但由于我们对NLRs的作用模式和结构的认识存在差距,特别是那些成对运作的NLRs,这些方法仍然很复杂。当这些空白被填补后,几乎有可能创造出能够识别各种生物营养或半生物营养病原体的工程化NLR受体。
在未来,CRISPR介导的利用碱基编辑或者原生编辑,加之获得性抗性突变体筛选,对于NLR的进化发展,获得新的效应子识别抗性作物提供了有效的策略。然而,这些发展需要等我们彻底理解NLR功能,精确靶向的模体,还要防止由于过度免疫造成的其他农艺性状的改变的基础上,最终可以平衡病原菌侦测和适应。
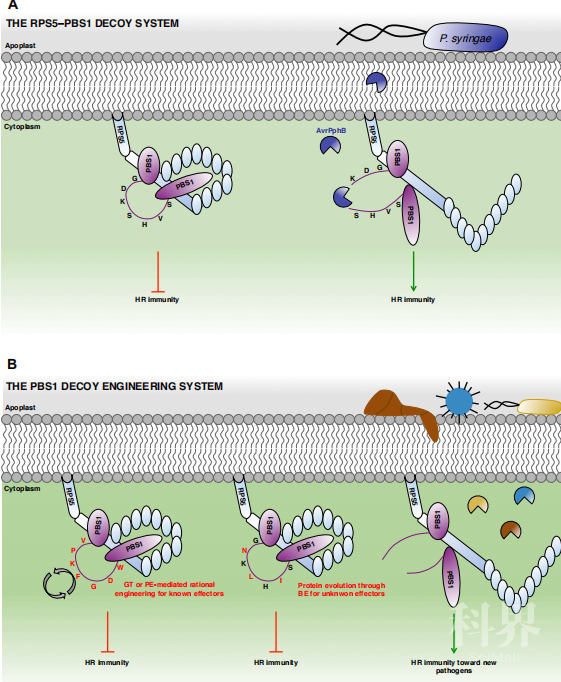
在许多情况下,NLRs对效应子的识别是间接的,通过检测效应子介导的植物蛋白修饰,即所谓的保护子或诱饵发生。抗性工程的一个有前途的策略是修改这些诱饵或保护子以捕获新的病原体效应物。在拟南芥中使用丝氨酸-苏氨酸激酶PBS1为这一概念提供了证明,其被细菌效应物AvrPphB的裂解由NLR的 RPS5监测。用携带其他细菌或病毒蛋白酶的裂解位点的PBS1突变体转化RPS5植物,导致这些蛋白酶的识别和新的细菌或病毒抗性。使用基因组编辑工具,如CRISPR介导的同源重组或原生编辑,编码PBS1的7个残基裂解位点的内源位点可以很容易地被修饰成其他病原蛋白酶的裂解位点,导致RPS5介导的对这些新型效应物的监视。PBS1在开花植物中高度保守,NLR介导的对其裂解的监视在进化中反复出现,使其成为相应作物中的多功能诱捕系统。更一般地说,类似的蛋白酶或其他效应子的诱捕系统,即使不具备PBS1监视系统,也可能在大范围的作物中设计出其他诱饵或保护子。// 宿主因子工程由于NLR介导的抗性常常被病原体迅速绕过,S-基因工程构成了抗性来源多样化的一个令人兴奋的选择。S-基因可以被病原体效应因子靶向或独立作用,促进病原体感染,可以编码参与宿主识别、穿透或代谢的蛋白质,或作为植物免疫的调节器。与R基因一般为显性遗传相反,工程化S因子赋予的易感性丧失主要是隐性遗传,即所有等位基因都应改变才能达到抗性。当然,这对多倍体植物来说是一个实质性的挑战。迄今为止,大多数以赋予病原体抗性为目的的基因组编辑应用都是通过敲除S基因来实现的。然而,这种策略可能会带来有害的副作用。由于S基因可能为宿主编码必要的蛋白质,因此会产生影响。
例如,细菌和真菌感染导致植物/病原体界面对碳资源的竞争,其中宿主糖运输体的相互作用的结果起着关键作用。为了增加细胞质中的糖供应,黄单胞菌激活水稻SWEET基因家族成员的转录,这些成员编码介导蔗糖被动扩散穿过质膜的蛋白质。这是通过所谓的转录激活剂样效应子(TALEs)的表达来实现的,该效应子结合SWEET启动子的特定区域以激活转录,导致蔗糖向维持细菌生长的细胞器的运输增强。由于SWEET蛋白是长距离运输蔗糖的分生体负载的关键成分,CRISPR介导的功能丧失方法可能会导致不必要的发育影响。在这方面,启动子靶向是一种有吸引力的替代方法,包括将随机的插入突变引入TALE结合元件。这样的策略是通过靶向一些OsSWEET基因进行的,从而防止OsSWEET被细菌效应子诱导,并赋予细菌枯萎广谱抗性。同样,CRISPR-Cas9/Cas12a介导的CsLOB1基因启动子编辑,特异性地靶向细菌效应子进行转录激活,从而产生抗痈柑橘栽培品种。由于Cas9核酸酶大多诱导小的缺失,我们推测这种策略可以使用Cas12a和Cas12b核酸酶进行改进,从而获得更高的大的缺失率,如前所述。使用放宽PAM的Cas变体。识别以精确地靶向顺式调节元件。
随着最近CRISPR工具箱的扩展,现在可以编辑特定的碱基,导致预定的准时氨基酸变化,目的是开发新的或模仿自然等位基因赋予抗性。真核生物启动因子4E(eIF4E)基因是真核生物蛋白质合成的关键因子。同时,它们也是大型马铃薯病毒家族成员非常重要的易感因子,它们依靠这些因子在植物中产生循环感染。在各种植物物种中发现的天然抗性通常依赖于编码序列中含有非同义突变的功能性抗性eIF4E等位基因。这些等位基因没有与丧失功能等位基因相关的健身成本或发育缺陷。此外,已经表明,部署这些功能性等位基因可以降低抗性降低的风险。因此,最近通过CBE介导的单氨基酸突变(N176K)将拟南芥eIF4E1易感等位基因转化为抗性等位基因,且没有任何产量影响。预计这种方法可以推广到任何没有对壶状病毒和相关单链阳性RNA病毒天然eIF4E抗性等位基因的作物。然而,目前的碱基编辑工具本身对产生与抗性相关的大范围的氨基酸变化是相当有限的,而这些氨基酸变化可以在不同物种间复制,因此,预计原生编辑可以大大有助于设计新的抗性等位基因,以更准确地模拟天然抗性等位基因,与易感等位基因相比,这些等位基因可以聚集多达5个独立的非同义氨基酸变化。预计这种更多的突变数量将有助于提高该等位基因的抗性谱以及抗性持久性。
除了翻译起始因子外,还有大量的S基因可供设计作为新的抗性资源。对其他宿主因子的精确修饰可以阻止被病原效应子识别,比如生长素相应因子(ARF)被斐济病毒蛋白作为靶向,可以在未来被作为额外的对植物病毒的抗性机制。我们希望多种宿主因子可以在接下来的时间被精确编辑,提供了广谱病原菌抗性作物的新的育种的方法。//瓶颈和展望在过去的几年,CRISPR技术在植物领域快速发展,已经至少理论上达到可以几乎编辑基因组的任何位点。当新的原生编辑系统发展提高,植物学家们可以用于大量多样的基因组编辑工具对功能基因组和分子作物育种。
然而,除了CRISPR系统本身,递送基因组编辑到植物细胞仍然有主要的技术限制。虽然转基因技术,比如水稻,小麦,番茄或者土豆已经非常成熟,但是一些利用CRISPR的作物精准育种瓶颈仍然存在。首先,经典的递送方法包括农杆菌介导的转化,原生质体转染,还有一些体细胞的转化都包括了重生状态(愈伤)非常花时间,而且对于基因型非常依赖。更多的问题在于通过这些递送和组织培养的方式会造成不必要的基因组改变,正如最近的四倍体土豆原生质体及农杆菌转化,还有一些水稻和玉米基因枪的结果。第二点,最常用的递送方法包括稳定整合外源DNA到植物基因组中。那么这些序列可以用孟德尔遗传方法去除,减少脱靶效应,特别是碱基编辑。更多的疑虑在于外源引入DNA会造成全基因组的随机插入,这对于非DNA递送的方法有了迫切的需求。正如这样的结果,当我们可以通过高特异性CRISPR方法对靶点进行精确编辑时,发展不同的递送方法来躲避和限制这种效应很重要,解决了这些问题,这才能真正释放CRISPR技术的全部潜力。
最后,以上证据都表明CRISPR技术对于植物生物学研究和精准农业育种都有巨大的潜力。CRISPR工具箱在意非常快的速度进行延伸和传播,绝对能够帮我们解开植物对于病原菌感染的免疫反应。然而,我们现在只能模拟或者进化对于广谱病原菌遗传抗性免疫分子机制,这些潜力能够支持可持续的食品安全,减少化学农药使用。调控框架仍然是CRISPR在食品作物运用的主要障碍,特别是欧洲。我们希望基于产品调控框架能够提供一个合理的对于人/环境安全考量和植物育种创新的平衡。
来源:PlantRSS iPlants
原文链接:https://mp.weixin.qq.com/s?__biz=MzUzNzczODE4Mg==&mid=2247498623&idx=3&sn=54d75c4a143ce628b58521dff90a4874&chksm=fae0d5d6cd975cc0932345ee0b4d3d35c9d868ec466a72f6a3ad3625a600108f987d282ec04c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



