来源:中华医学会糖尿病学分会
点击蓝字关注我们
文章来源:中华糖尿病杂志,2020,12 (06): 424-428
作者: 李琳 李全民
单位:解放军火箭军特色医学中心
摘要
2019年底美国糖尿病协会发布了2020版糖尿病诊治指南。根据新的研究证据,指南中对糖尿病肾病的诊治进行了更新。引入了新的慢性肾脏疾病分期方法,更新了糖尿病肾病患者筛查、监测及治疗推荐;提高了钠-葡萄糖协同转运蛋白2抑制剂在糖尿病肾病防治中的地位;更新了血管紧张素转换酶抑制剂和血管紧张素Ⅱ受体拮抗剂对糖尿病肾病一级预防的研究证据;新增对急性肾损伤及糖尿病肾病营养治疗的关注。同时,对糖尿病肾病临床治疗进展进行简要介绍。一、DKD筛查与肾功能评估频率的更新
DKD筛查一直是ADA指南推荐的主要内容,2020年指南除关注筛查外,对于一旦诊断DKD(或并发慢性肾脏病)的糖尿病患者,为指导治疗,建议应该每年两次监测尿白蛋白和eGFR。
DKD的临床诊断主要基于糖尿病患者尿白蛋白增加和(或)eGFR减低[3]。虽然UACR有不同的检测间变异率偏高的缺点,但目前UACR仍是最方便诊断DKD的指标。在排除24 h内运动、感染、发热、充血性心力衰竭、月经、显著高血糖、显著高血压后,3~6个月内测定3次UACR中2次以上增高(>30 mg/g),即可诊断DKD。UACR增高是DKD的常见表现,但近年来,糖尿病患者中无UACR增高的eGFR降低报道越来越多[4],糖尿病患者无视网膜病变、无原发肾脏疾病原因的eGFR降低[<60 ml·min-1·(1.732)-1]也是诊断DKD的指标。新ADA指南中,糖尿病患者一旦UACR>30 mg/g和(或)eGFR<60 ml·min-1·(1.732)-1即诊断为DKD,就推荐增加监测次数,以便指导治疗及监测病情变化。而且推荐的每年监测次数高于肾脏病改善全球预后指南(kidney disease: improving global outcomes,KDIGO)[5]推荐的次数。
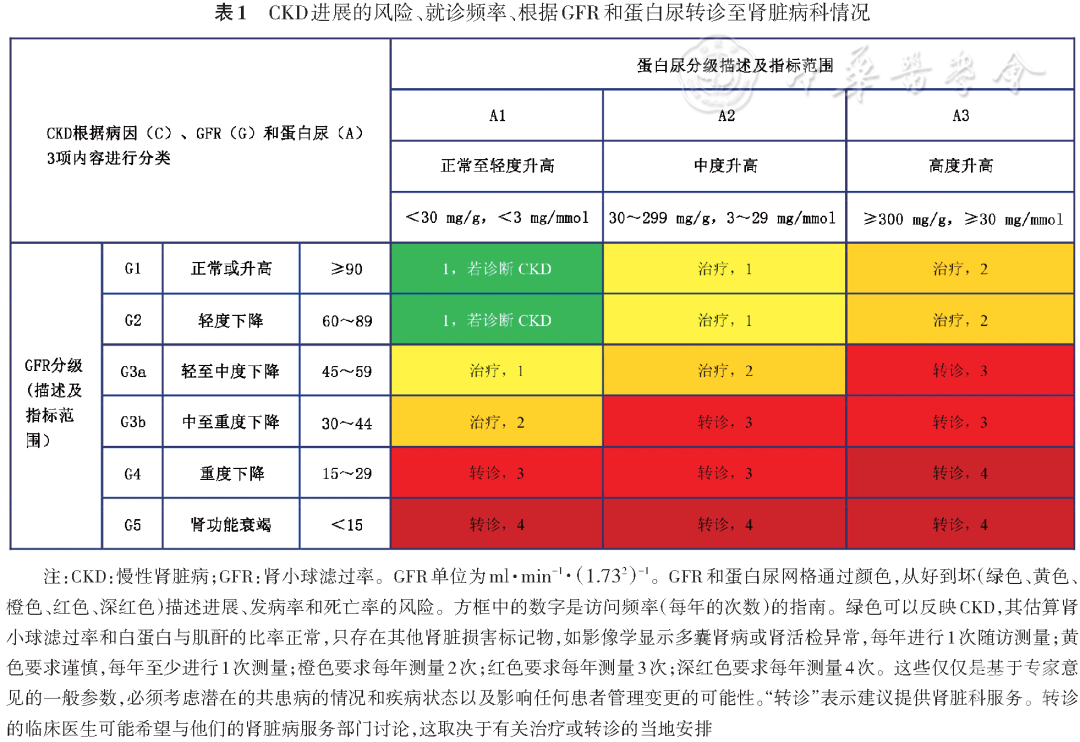
二、引入新的慢性肾脏病分期表格
新的CKD分期方法对临床诊疗具有更大的指导作用。如有两个DKD患者eGFR均为50 ml·min-1·(1.732)-1,A患者UACR<30 mg/g,B患者UACR为3 000 mg/g,按照传统的CKD分期方法,两例都是肾功能不全G3a期,并不能提供他们在预后、肾脏疾病进展速度及治疗方案选择上的区别。而按照新的分期,虽然两例患者的eGFR都是50 ml·min-1·(1.732)-1,但由于UACR不同,A患者CKD分期是G3aA1期,B患者CKD分期G3aA3。对应的两个分期表格颜色有明显区别,A患者是心血管事件、死亡的较低风险人群,肾脏疾病进展速度较慢;B患者是心血管事件、死亡的高风险人群,肾脏疾病进展速度较快。两例患者需要就诊的次数和监测eGFR、尿白蛋白的次数分别是每年1次和3次。两例患者的治疗方案也有明显的区别,一般而言,eGFR高低是决定药物剂量、是否有禁忌的基本指标,而UACR多少是选择抗高血压药物、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)或血管紧张素Ⅱ受体拮抗(angiotensin receptor blockers,ARB)、钠-葡萄糖协同转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)等延缓肾功能进展药物的依据。
2020年ADA指南中新增分期见表1[1]。
三、SGLT2i与胰高血糖素样肽1受体激动剂(glucagon-like peptide 1 receptor agonist,GLP-1RA)的临床应用推荐更新
2020年指南中,对于2型糖尿病合并CKD监测且eGFR≥30 ml·min-1·(1.732)-1、UACR>30 mg/g(尤其UACR>300 mg/g)的患者,为降低CKD进展和(或)心血管事件风险,推荐使用SGLT2i(证据级别A)。对于2型糖尿病合并CKD且有心血管事件高风险的患者,使用GLP-1RA可能减少蛋白尿进展和(或)心血管事件的风险(证据级别C)[1]。
通过对比,可以发现2020年指南较2019年进行了重要更新。2019年指南推荐2型糖尿病合并CKD患者可以应用SGLT2i和GLP-1RA,但证据级别(C)较低,而且两种药物的推荐没有区别。2020年指南中指出,SGLT2i能够延缓CKD进展、和(或)减少心血管事件,证据可靠,为A级证据。而GLP-1RA的推荐变化较小,与2019年指南推荐基本相同,只是把应用GLP-1RA可能延缓DKD进展改为可能降低尿蛋白进展,证据等级较弱,依旧为C级证据。
SGLT2i对DKD的治疗作用备受关注。前期在SGLT2i的大型心血管结局研究中发现,SGLT2i除了可以减少研究的主要终点心血管事件外,次要终点肾脏事件也获得了很好的结果。如EMPA-REG研究(恩格列净的心血管结局研究)[6]、CANVAS研究(卡格列净心血管结局评估研究)[7]结果均显示与安慰剂相比,SGLT2i降低了2型糖尿病患者肾病的发生或恶化的风险。虽然以上研究均显示2型糖尿病合并CKD患者应用SGLT2i肾脏终点获益明显,但这些研究的主要目的是为评估SGLT2i的心血管安全性,主要终点是心血管事件,肾脏事件只是次要终点。而且这些研究选择的人群主要为合并心血管疾病或有心血管疾病高风险因素2型糖尿病患者,并未主要针对2型糖尿病合并CKD选择研究人群。因此,肾脏终点的检验效能较低、可靠性较弱,故在2019年ADA指南指出,DKD患者使用SGLT2i可能延缓肾病进展,证据级别仅为C级。
2019年,大型临床试验CREDENCE(卡格列净在已确诊肾病的糖尿病患者中的肾脏终点研究)结果发布,为SGLT2i在DKD中的应用提供了强有力的证据。这项研究主要入选的患者是糖尿病合并CKD患者,主要终点是肾脏临床终点,是在4 401例2型糖尿病且UACR平均值≥300 mg/g、eGFR平均值56 ml·min-1·(1.732)-1的患者中使用卡格列净和安慰剂的研究。其主要复合终点为终末期肾病、血清肌酐倍增,或肾脏、心血管死亡[8, 9],结果显示,卡格列净组终末期肾病发生的风险比安慰剂组降低了32%,风险比(hazard ratio,HR)为0.68,95%可信区间(confidence interval,CI)为0.54~0.86,P=0.002。特别需要指出的是,卡格列净是在绝大部分患者应用ACEI或ARB的治疗基础上得到的获益。因此,SGLT2i延缓2型糖尿病患者CKD进展具有强有力的证据,2020年指南中证据等级提升为A。
CREDENCE研究和SGLT2i心血管结局研究的二次分析发现,SGLT2i可以使eGFR低到30 ml·min-1·(1.732)-1的2型糖尿病患者心血管和肾脏事件减少,甚至独立于降糖效果[10]。SGLT2i具有抑制葡萄糖重吸收、减轻体重、降压、减低肾间质压力等作用,SGLT2i还可以减少肾脏内氧化应激、减少血管紧张素原、降低含热蛋白结构域蛋白3炎性复合体活性[11],这些结果都支持SGLT2i肾脏保护作用独立于降糖之外。
在LEADER研究(利拉鲁肽心血管结局研究)的次要终点中发现,利拉鲁肽可以使2型糖尿病患者,肾病新发或恶化的风险降低22%,HR为0.78,95%CI为0.66~0.93,P=0.007[12],而SUSTAIN-6(索马鲁肽的心血管安全性研究)提示,索马鲁肽使2型糖尿病患者DKD新发或恶化风险降低36%[13]。但是以上研究主要终点均是心血管事件,肾脏事件是次要终点,证据等级偏低。故在2020年ADA指南中有关GLP-1RA的证据等级无变化,GLP-1RA对DKD的获益也更科学地描述为“可能减少尿蛋白”,证据级别C。目前,GLP-1RA对DKD有确切治疗效果的研究正在进行中,期待索马鲁肽的FLOW试验能带来新的信息[14]。
四、ACEI或ARB的使用
2020年ADA指南推荐内容相同,但证据级别提升到A[1]。
ACEI或ARB是糖尿病伴高血压,eGFR<60 ml·min-1·(1.732)-1和(或)UACR≥300 mg/g患者的首选降压治疗药物,上述应用被证实可以延缓CKD进展[15]。而对于血压、UACR(<30 mg/g)和eGFR都正常的糖尿病患者是否应用ACEI或ARB进行CKD的一级预防,2020年ADA指南明确提出不推荐,且证据等级由B提升为A。更新依据来源于下列研究。在一项入选人群为既无白蛋白尿也无高血压1型糖尿病患者的研究中,结果显示ACEI或ARB未能预防通过肾活检评估的糖尿病性肾小球疾病的发展[16]。这一结论在另一项2型糖尿病患者的类似研究中得到了进一步证实[17]。以上两项长期的双盲研究的结果表明,在血压正常、UACR正常(<30 mg/g)和eGFR正常的1型和2型糖尿病患者中,ACEI或ARB无肾脏保护作用。
五、新增关注急性肾损伤的推荐
急性肾损伤(acute kidney injury,AKI)一般依靠血清肌酐在短期内持续升高50%或以上进行诊断,其反映了eGFR的快速降低[18]。糖尿病患者AKI的风险高于非糖尿病患者[19]。因为AKI与CKD进展和其他不良健康结局的风险增加有关,因此及时识别和治疗AKI非常重要。AKI的风险因素包括已存在的CKD、使用导致肾损伤的药物(如非甾体类抗炎药),以及使用改变肾血流和肾内血流动力学的药物。尤其是许多抗高血压药物(如利尿剂、ACEI和ARB)可以减少血容量、肾血流量和(或)肾小球滤过。有学者担心SGLT2i可能通过减少血液容积促进AKI,特别是当与利尿剂或其他减少肾小球滤过的药物联合使用时。然而,在SGLT2i心血管安全性研究中,肾功能正常或肾功能较差的患者[15]和安慰剂组比较并未发现应用SGLT2i增加AKI发生率。ACCORD-BP研究分析表明,那些随机接受强化降压治疗同时出现血清肌酐升高30%的患者,其死亡率或肾病进展无任何增加[20, 21, 22]。此外,血肌酐增加患者,AKI的各种生物标志物都没有显著增加[22]。故使用肾素-血管紧张素系统阻滞剂时,血清肌酐的小幅度升高(比基线水平高30%内)不要与AKI混淆[23]。因此,在2020年ADA指南中,特别新增建议,即在没有容量不足的情况下,不要因血清肌酐轻度增加(<30%)而停止ACEI和ARB的使用(证据等级B)。此项推荐对于使用SGLT2i遇到血清肌酐轻度增加时是否继续使用可能也有一定参考意义。
六、营养
七、DKD治疗药物研究进展
目前,有关DKD治疗的许多研究正在进行中,如盐皮质激素受体拮抗剂、转化生长因子-β抑制剂、糖基化终末产物受体拮抗剂、磷酸二酯酶抑制剂、5-羟色胺2a受体拮抗剂、中药及干细胞也正处在临床研究阶段。下面就近期发表的DKD临床研究进行简要介绍。
SONAR是一项内皮素A受体拮抗剂-阿曲生坦的双盲、随机、安慰剂对照试验研究,研究结果2019发表在Lancet上[26]。研究的纳入标准为使用肾素-血管紧张素系统抑制剂后仍有持续性大量蛋白尿的2型糖尿病患者。根据开放式治疗期间蛋白尿的变化确定应答者状态。所有纳入SONAR研究的受试者被分为应答组(在应用阿曲生坦6周内蛋白尿减少>30%)和无应答组,应答组被随机分配到阿曲生坦组(1 325例,0.75 mg/d)或安慰剂组(1 323例),中位随访2.2年(四分位数间距为1.4~2.9),主要复合终点是血清肌酐倍增、终末期肾病或肾脏死亡。研究结果显示,两组主要终点的发生率是阿曲生坦组79例(6.0%),安慰剂组105例(7.9%),HR为0.65,95%CI为0.49~0.88,P=0.004 7。然而和安慰剂相比,阿曲生坦更容易发生液体潴留,但阿曲生坦组心力衰竭住院率并无显著增加,这一结果提示内皮素受体拮抗剂DKD患者具有延缓肾病进展的作用。
PERL研究是一项在T1DM患者中进行,旨在评估使用别嘌呤醇降低血尿酸(serum uric acid,SUA)能否减缓DKD进展的研究[27],在2019年美国肾脏病年会上发布了试验结果。这项双盲、安慰剂对照、多中心试验共入组530例T1DM患者,这些患者的eGFR为40.0~99.9 ml·min-1·(1.732)-1,血清尿酸≥4.5 mg/dl,有微量至大量蛋白尿(79.1%)或正常蛋白尿伴年eGFR下降≥3 ml·min-1·(1.732)-1,随机分为别嘌呤醇组(n=267)或安慰剂组(n=263)。主要终点是基线校正的GFR水平变化。经过3年治疗后,结果显示,尽管别嘌呤醇有效地降低了血清尿酸,但两组的肾小球滤过率下降差异无统计学意义。PERL是迄今为止规模最大的关于别嘌呤醇治疗的CKD试验,在伴有轻中度GFR下降和血尿酸高于中位水平的T1DM患者中,没有发现血尿酸下降对肾脏疾病进展有显著益处。
VITAL-DKD研究是2019发表于JAMA的一项研究[28],研究对象为1 312例2型糖尿病患者平均eGFR为85 ml·min-1·(1.732)-1,研究目的是探讨补充维生素D和ω-3脂肪酸能否延缓eGFR降低。经过5年的研究,研究结论是2型糖尿病患者,常规补充维生素D或ω-3脂肪酸并不能降低慢性肾病的发病率或延缓eGFR的下降。
参考文献 略来源:中华糖尿病杂志

来源:CDS-TNB 中华医学会糖尿病学分会
原文链接:http://mp.weixin.qq.com/s?__biz=MzI1ODE4ODkxMg==&mid=2247491285&idx=4&sn=d811e4bc3df5f5fc9a9c3160bb10146c&chksm=ea0aadcadd7d24dcac547c89889ab69787492ee2044f1792104ab24adbcc3c5f98fcc9f70827&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



