来源:病毒学界
冠状病毒在系统分类上属于冠状病毒科(Coronaviridae),是一个单链正义包膜RNA病毒的大家族,可感染大多数动物(人类以及家畜和野生动物)。已知它们拥有最大的病毒RNA基因组,由四个属组成【1】。一般来说,人类冠状病毒感染会导致轻微的呼吸道症状,众所周知,冠状病毒是普通感冒的主要原因之一【2】【3】。然而,在过去的18年里,我们目睹了高致病性人类冠状病毒的出现,包括严重急性呼吸综合征相关冠状病毒(SARS-CoV-1)、中东呼吸综合征相关冠状病毒(MERS-CoV),并且在2019年底,出现了严重急性呼吸综合征相关冠状病毒2型(SARS-CoV-2)【4】。SARS-CoV-2是冠状病毒相关的急性呼吸系统疾病或冠状病毒疾病19(COVID-19)的始作俑者,对全球健康构成重大威胁,迫切需要协调一致的努力来治疗病毒感染并阻止大流行。
尽管SARS-CoV-2主要针对肺上皮细胞,引起呼吸道感染,但越来越多的证据表明肠上皮细胞也可能受到感染,同时研究表明,在人体中,胃肠道、肾脏和睾丸中有高表达的ACE2蛋白【5】。多项研究报告了疾病开始时的胃肠道症状,如腹泻,并检测到即使在口咽拭子中检测不到冠状病毒基因组,也会在粪便中长时间脱落【6】【7】【8】【9】【10】。尽管有一项研究揭示了从粪便样本中分离出传染性病毒颗粒【11】,但至今仍不清楚有多少人在粪便中传播感染性病毒。最关键的是,SARS-CoV-2是否有通过粪便传播的可能性仍然未知,但全球多家卫生机构都强调了这种可能性。
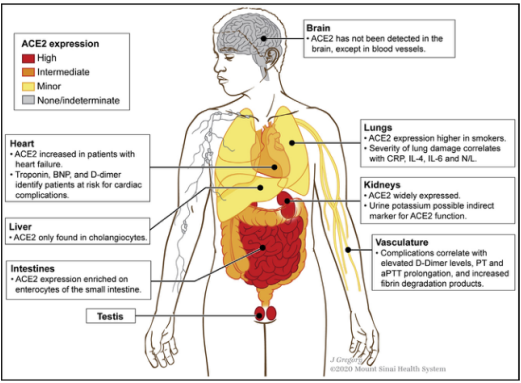
图1 ACE2在器官和系统中的表达情况
2020年7月7日,德国癌症研究中心的Steeve Boulant在国际著名学术期刊Cell Reports上在线发表了题为Critical Role of Type III Interferon in Controlling SARS-CoV-2 Infection in Human Intestinal Epithelial Cells的研究报告。研究揭示了SARS-CoV-2可感染人小肠上皮细胞(hIECs),同时hIECs可以支持SARS-CoV-2的复制并且产生新生病毒,在此基础上探究发现Ⅰ型和Ⅲ型干扰素可控制hIECs感染SARS-CoV-2(见图2)。
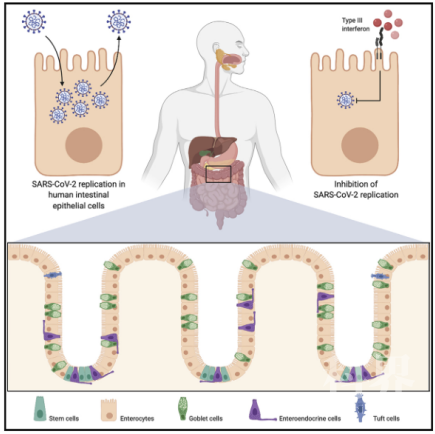
图2 Ⅲ型干扰素能够抑制SARS-CoV-2在hIECs中的复制
用SARS-CoV-2分别侵染T84和Caco-2细胞,发现Caco-2细胞在病毒侵染4小时后能够检测到感染细胞,同时在侵染24小时后大多数细胞受到感染;T84细胞同样能够感染SARS-CoV-2,但是在病毒感染后24小时仅仅只有约20%的细胞受到感染。因此,与T84细胞相比,Caco-2细胞感染SARS-CoV-2导致更弱的固有免疫,这表明IFN介导的免疫反应控制了hIECs的SARS-CoV-2感染。(见图3)
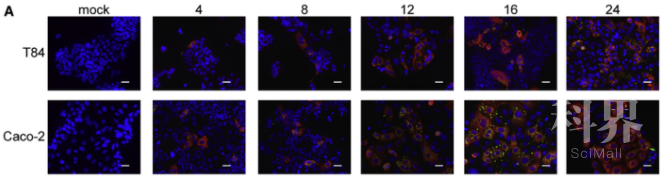
图3 T84细胞和Caco-2细胞感染SARS-CoV-2的情况
通过敲除干扰素受体蛋白,发现敲除Ⅰ型干扰素受体蛋白(AR-/-)后,受SARS-CoV-2感染的细胞数量有轻微的升高;但是敲除Ⅲ型干扰素受体蛋白(LR-/-)后,受SARS-CoV-2感染的细胞数量升高了7倍。同时敲除AR-/-和LR-/-与敲除LR-/-获得的效果相同。(见图4)
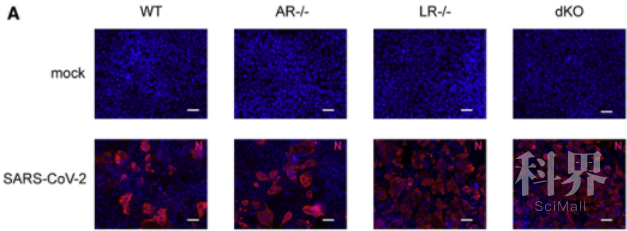
图4 T84细胞敲除AR-/-和LR-/-后感染SARS-CoV-2的情况
该研究不仅通过实验验证了SARS-CoV-2可以感染人体胃肠道,并有效的产生新病毒。更加重要的是,发现了细胞因子Ⅰ型和Ⅲ型干扰素可以作为抗病毒策略,避免SARS-CoV-2的侵染。
1. Cui, J., Li, F., and Shi, Z.-L. (2019). Origin and evolution of pathogenic corona-viruses. Nat. Rev. Microbiol. 17, 181–192
2. Moriyama, M., Hugentobler, W.J., and Iwasaki, A. (2020). Seasonality of respiratory viral infections. Annu. Rev. Virol. Published online March 20, 2020
3. Zhao, Y., Zhao, Z., Wang, Y., Zhou, Y., Ma, Y., and Zuo, W. (2020). Single-cell RNA expression profiling of ACE2, the receptor of SARS-CoV-2. bioRxiv.
4. Lu, H., Stratton, C.W., and Tang, Y.-W. (2020). Outbreak of pneumonia of unknown etiology in Wuhan, China: The mystery and the miracle. J. Med. Virol.92, 401–402.
5. Nicolas, Vabret., et al. (2020). Immunology of COVID-19: Current State of the Science. Immunity.
6. Wu, Y., Guo, C., Tang, L., Hong, Z., Zhou, J., Dong, X., Yin, H., Xiao, Q., Tang,Y., Qu, X., et al. (2020b). Prolonged presence of SARS-CoV-2 viral RNA in faecal samples. Lancet Gastroenterol. Hepatol., 0.
7. Xiao, F., Tang, M., Zheng, X., Liu, Y., Li, X., and Shan, H. (2020). Evidence for gastrointestinal infection of SARS-CoV-2. Gastroenterology 158, 1831–1833.e3.
8. Xing, Y.-H., Ni, W., Wu, Q., Li, W.-J., Li, G.-J., Wang, W.-D., Tong, J.-N., Song,X.-F., Wing-Kin Wong, G., and Xing, Q.-S. (2020). Prolonged viral shedding in feces of pediatric patients with coronavirus disease 2019. J. Microbiol. Immunol. Infect. 53, 473–480.
9. Xu, Y., Li, X., Zhu, B., Liang, H., Fang, C., Gong, Y., Guo, Q., Sun, X., Zhao, D.,Shen, J., et al. (2020b). Characteristics of pediatric SARS-CoV-2 infection and potential evidence for persistent fecal viral shedding. Nat. Med. 26, 502–505.
10. Wolfel, R., Corman, V.M., Guggemos, W., Seilmaier, M., Zange, S., M€ uller,M.A., Niemeyer, D., Jones, T.C., Vollmar, P., Rothe, C., et al. (2020). Virological assessment of hospitalized patients with COVID-2019. Nature 581, 465–469.
11. Wang, W., Xu, Y., Gao, R., Lu, R., Han, K., Wu, G., and Tan, W. (2020). Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA.
来源:viramedia 病毒学界
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyMzQ3NTMyMQ==&mid=2247499895&idx=2&sn=7b7bdf99c712da07af3fe7255f32da36&chksm=e81f2361df68aa77dc9fdad4789f1c34620e095c223828047e1635327032a1c05765c04e0fa2#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



