来源:医世象
"肺癌是全球癌症死亡的主要原因,包括非小细胞肺癌和小细胞肺癌,其中非小细胞肺癌(NSCLC)是最常见的癌症类型之一,约占85%。晚期非小细胞肺癌在经历了化疗、靶向治疗时代之后,目前已全面进入了以免疫检查点抑制剂(ICIs)为代表的的免疫治疗新时代。"免疫检查点抑制剂(ICIs),包括PD-(L)1及CTLA-4抑制剂,独特地利用人体自身的免疫系统来帮助机体恢复抗肿瘤免疫反应,它们并不直接攻击癌细胞,而是通过激活人体自身免疫系统来抗击肿瘤,具有良好的安全性及耐受性。
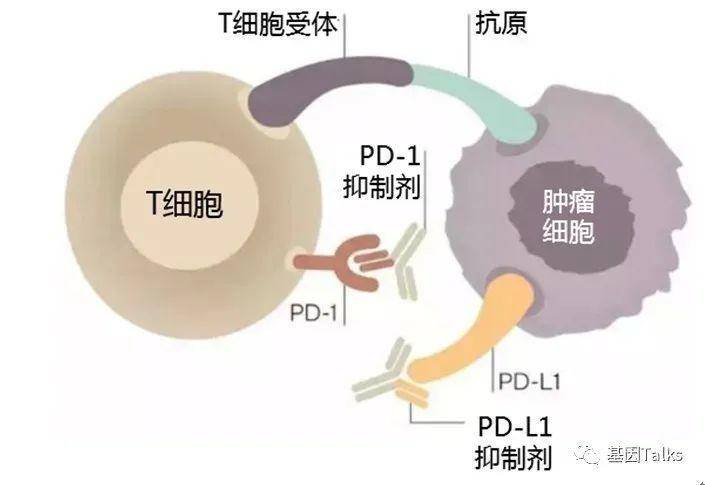 ▲ 肿瘤免疫检查点抑制剂原理
▲ 肿瘤免疫检查点抑制剂原理近期,FDA相继批准了多款靶向药物及免疫药物,促进了肿瘤精准医疗时代的快速发展。
2020年5月15日,FDA批准了PD-1单抗纳武利尤单抗(Nivolumab,O药,BMS)联合CTLA-4单抗伊匹木单抗(Ipilimumab,Y药,BMS)用于肿瘤细胞PD-L1表达≥1%(TPS≥1%)且肿瘤细胞无 EGFR 或 ALK 变异的转移性非小细胞肺癌患者的一线治疗。
同时,FDA还批准了 PD-L1 IHC 28-8 pharmDx(Agilent)作为其伴随诊断设备,用于选择适合纳武利尤单抗+伊匹木单抗治疗的NSCLC患者。
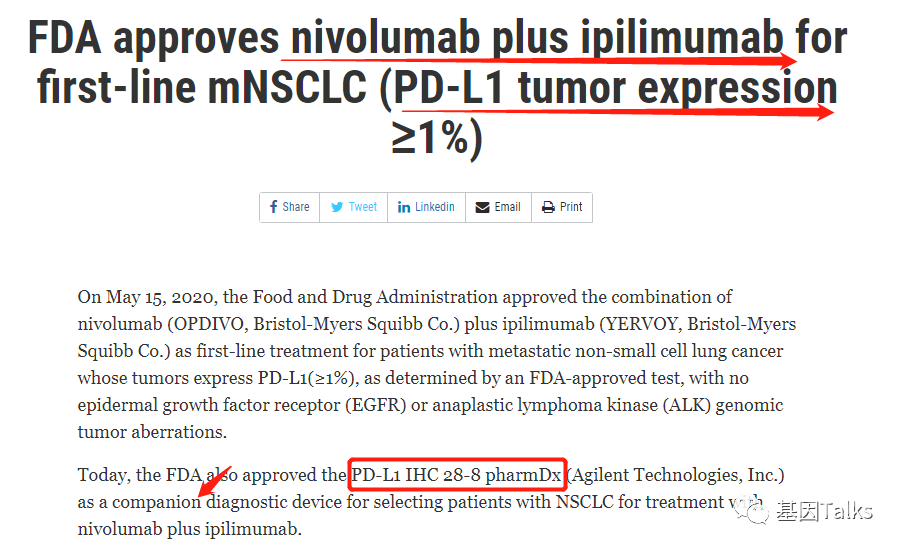
▲ NSCLC一线O+Y药及伴随诊断
仅隔两日,2020年5月18日,FDA又批准了PD-L1单抗阿替利珠单抗(Atezolizumab,T药,Roche旗下Genentech)用于肿瘤细胞PD-L1表达≥50%(TC≥50%)或肿瘤浸润免疫细胞PD-L1表达≥10%(IC≥10%)且肿瘤细胞无 EGFR 或 ALK 变异的转移性非小细胞肺癌患者的一线治疗。同时,FDA还批准 VENTANA PD-L1(SP142) Assay(Roche旗下Ventana)作为其伴随诊断设备,用于选择适合阿替利珠单抗治疗的NSCLC患者。
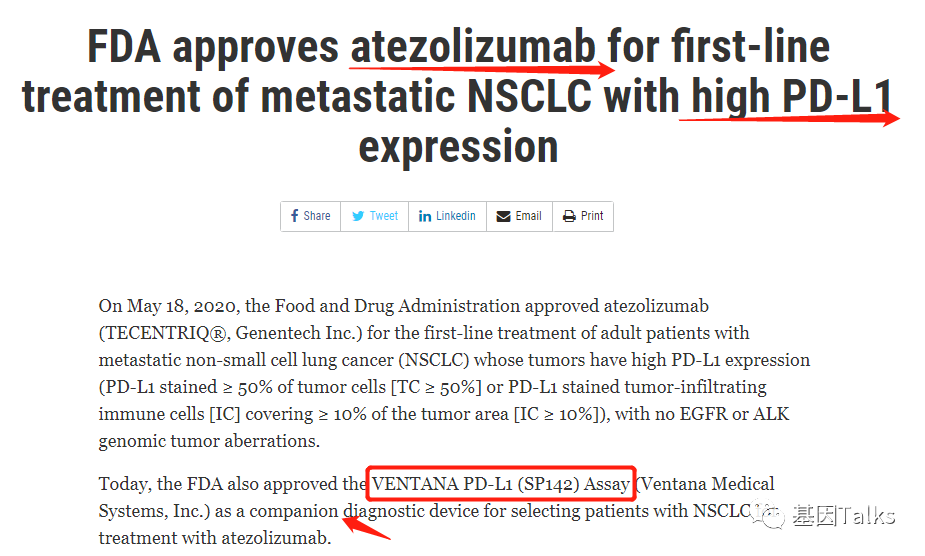
▲ NSCLC一线T药及伴随诊断
短短四天,FDA相继批准PD-1+CTLA-4(纳武利尤单抗+伊匹木单抗),PD-L1( 阿替利珠单抗)一线用于NSCLC,足以说明PD-1/PD-L1抑制剂确实是一种经临床证实有效的治疗手段。同时,FDA也批准了两款PD-L1表达检测产品(28-8/SP142)作为伴随诊断,足以说明即使PD-L1的争议很多,但PD-L1仍是目前循证医学证据最充分的免疫治疗标志物,也是临床应用最广泛的免疫治疗标志物,使用前应进行PD-L1的检测。
“PD-L1+EGFR/ALK基因检测”是关键!
最后,适用免疫治疗的NSCLC患者人群中,EGFR/ALK为阴性,足以说使用前应进行EGFR/ALK的基因检测,如果有突变则建议优先使用靶向药物进行治疗;EGFR/ALK野生型且PD-L1高表达则可以使用免疫治疗。
01O+Y联合治疗获批的临床试验结果
CHECKMATE-227试验(NCT02477826)对疗效进行了研究,这是一项随机、开放标签、多部分的临床试验,招募的是未接受过抗肿瘤治疗的转移性NSCLC患者或复发后未接受过抗肿瘤治疗的NCSLC患者(不包含EGFR/ALK变异的患者)。在该试验的第1a部分中,将793名肿瘤细胞PD-L1表达≥1%的患者进行随机分配,试验组(396名)患者接受纳武利尤单抗+伊匹木单抗治疗,对照组(397名)患者接受含铂双联化疗。
试验结果表明,在肿瘤细胞PD-L1表达≥1%的患者中,与对照组患者相比,试验组患者的总生存期(OS)在统计学上有显著改善。试验组的中位OS为 17.1 个月,对照组的中位OS为 14.9 个月(HR=0.79)。
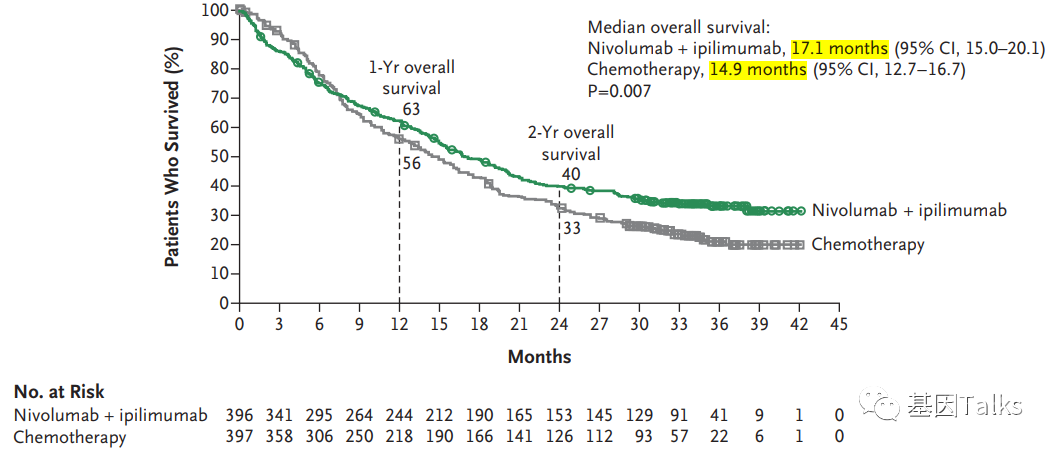
▲ PD-L1表达≥1%患者中,两组OS情况
试验组的中位无进展生存期(PFS,由BICR进行评估)为 5.1 个月,对照组的中位PFS为 5.6 个月(HR=0.82)。试验组和对照组确定的总体反应率(ORR,由BICR进行评估)分别为36%和30%。试验组的中位反应持续时间为 23.2 个月,对照组的中位反应持续时间为为 6.2 个月。02T药获批的临床试验结果
IMpower110试验(NCT02409342)是一项国际多中心、随机、开放标签的临床试验,招募的是肿瘤细胞PD-L1表达≥50%(TC≥50%)或肿瘤浸润免疫细胞PD-L1表达≥10%(IC≥10%)且未接受过化疗的IV期NSCLC患者(不包含EGFR/ALK变异的患者)。患者被随机分配(1:1)进入试验组和对照组,试验组患者每3周接受阿替利珠单抗1200mg治疗,直至疾病进展或出现不可接受的毒性,对照组患者接受以铂类为基础的化疗。主要疗效指标是总生存期(OS)。
试验结果表明,在肿瘤细胞PD-L1表达≥50%(TC≥50%)或肿瘤浸润免疫细胞PD-L1表达≥10%(IC≥10%)的患者中,与对照组患者相比,试验组患者的总生存期(OS)在统计学上有显著改善。阿替利珠单抗组患者的中位OS为 20.2 个月,而化疗组患者的中位OS为 13.1 个月(HR=0.59)。在中期或最终分析中,其它两个PD-L1亚组(TC≥5%或IC≥5%;TC≥1%或IC≥1%)的OS差异无统计学意义。
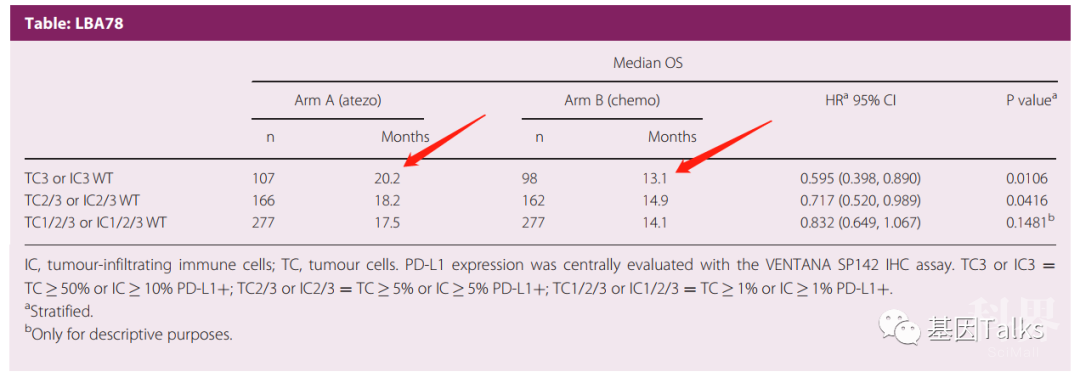
▲ PD-L1表达患者中,两组OS情况
由研究者进行评估的中位无进展生存期(PFS),在阿替利珠单抗组为 8.1 个月,在铂类为基础的化疗组为 5.0 个月(HR=0.63)。由研究者进行评估的确定总体反应率(ORR)分别为38%和29%。来源:medhealife 医世象
原文链接:https://mp.weixin.qq.com/s?__biz=MzU4NjUyNzYyOQ==&mid=2247498474&idx=2&sn=1af92d7fbdefdf8cf45856af880cc052&chksm=fdfb5c08ca8cd51ec7d7b262494657d4cc1d5e3bd78b4986f47707f6bb2462d8ee34845aefcd#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



