来源:brainnews
1、机器学习如何改变生物医学

机器学习适用于从大规模异质性的数据中寻找特征。在当下社会和科研中,机器学习已经多方面得到应用,例如游戏博弈、推荐系统、自动驾驶等等。而在生物医学领域,人们也已经将机器学习用于基因组分析、疾病诊断和药物研发等过程中。现在越来越多的研究项目认识到了机器学习的潜力,并投入到大规模的数据采集中。机器学习可分为监督和无监督型,其中包含集成学习、深度学习、贝叶斯学习等多类方法。作者接着列举了机器学习在生物医学多个关键领域内的应用:
提升临床图像和分子诊断水平
临床图像采集技术在飞速发展,人们现在已经可以获得三维甚至是四维的器官和组织图像了。许多基于深度学习的CAD软件也随之诞生,帮助医生解释图像含义,从而辅助糖尿病或是乳腺癌的诊断。通常训练数据集越大,深度学习的算法精确性越高。
分子化验可以从血液、唾液等样本中分析出遗传突变、基因表达等信息。由于其数据本身的高位特征,利用机器学习算法来寻找生物标志物是顺理成章的。在癌症生物学中,人们利用DNA甲基化和核小体位置来预测肿瘤起源与预后。将多种组学数据整合能产生更好的潜在效果。
多尺度建模和精确治疗
机器学习在生物医学中最有潜力的应用领域就是精准医疗。以癌症为例,面对个体携带的基因突变、疾病的不同阶段还有上百种不同的药物,人们希望利用机器学习算法精确地预测病人手术和用药后的反应。同时人们也在各个生物特征之间建模,例如预测基因突变是如何影响基因表达、可变剪切或者是转录因子结合。未来的模型将会想多维度和多任务的方向发展。
人们还希望,除了直接将治疗结果作为输出以外,算法还能对各种治疗手段进行排序,从而协助医生做临床决定。此外,机器学习还可被用来搜索文献或是公共数据库中的相关知识。
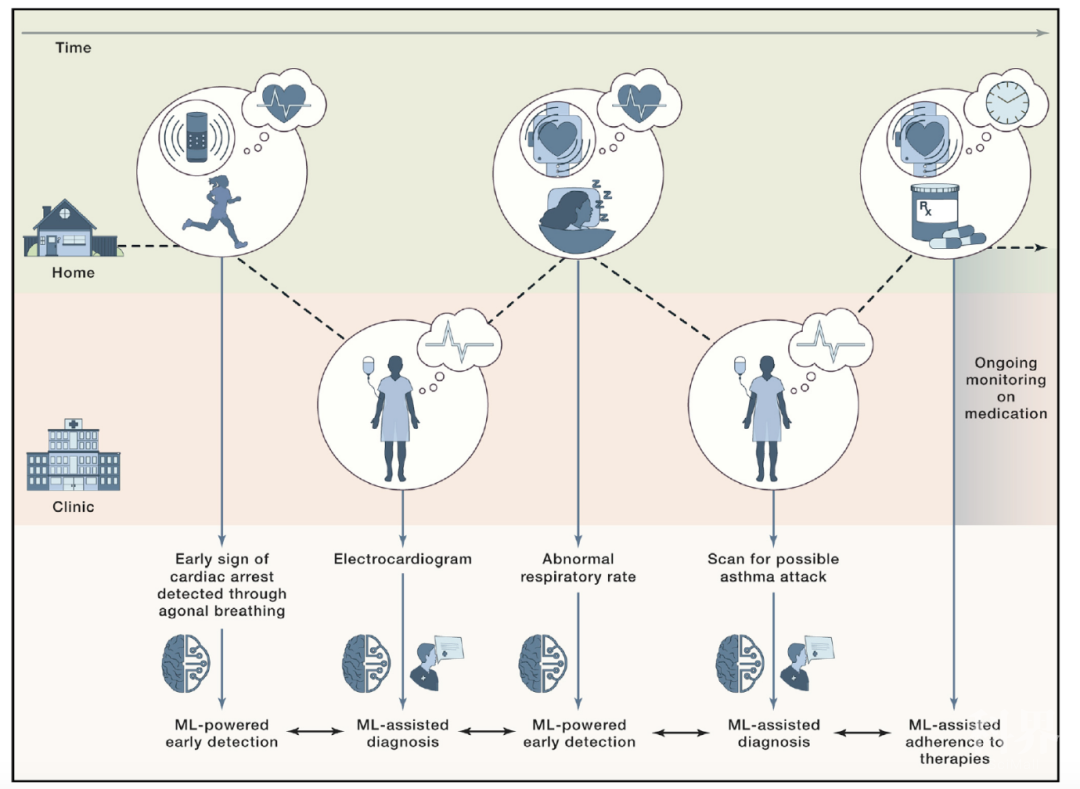
健康管理与调控
人们对于机器学习应用的预期,不仅在于疾病治疗,还有健康和疾病的控制管理。社会对于健康管理有着巨大的渴求,而通过整合在疾病预防和治疗上的理念,机器学习在其中大有可为。
可穿戴电子设备是最好的例子之一。人们时刻佩戴它们,来实施监测自身健康状态。他们采集海量数据,包括运动、脉搏、呼吸率、体温、血压、氧含量等等。这对于糖尿病,动脉硬化,心脏病乃至早发帕金森病都可能起到监测。研究者甚至希望将深度学习与手机拍照结合诊断皮肤癌。整合和建模大量健康数据是机器学习在健康管理中的关键角色。
人们有充分的理由在现代生物医学的各个环节使用机器学习来解决所面临的问题。建立能在疾病检测、诊断和治疗中扮演可靠角色的机器学习系统是未来的目标。
2、基于AAV载体递送的CRISPR基因编辑治疗
自从发现基因突变和损伤会造成疾病之后,基因治疗(gene therapy)就一直是人们的希望。然而传统的插入一个野生型基因拷贝的方法有许多局限性,它们缺乏表达调控,也不能解决获得型的病理突变。人们还是希望能在细胞的自然环境下修复基因。
其实细胞自身就有着一天重复上千次的修复系统。在面临DNA损伤或是双链断裂的时候,细胞会使用非同源末端连接(NHEJ)或同源定向修复(HDR)来恢复DNA序列。人们进一步观察到,由内切酶引发的双链断裂可以在真核细胞中激活HDR,因此开展了一系列寻找此类可编程的内切酶的研究,包括ZFN,TALEN和CRISPR-Cas系统。基于CRISPR的基因编辑是目前应用最广泛,也最具临床潜力的技术。基因编辑工具的体内递送依然是基因治疗的一大瓶颈,而腺相关病毒(AAV)载体是目前领先的递送平台。它产生免疫反应小,表达稳定,因此有诸多优势。本位对基于AAV的CRISPR基因治疗展开了一系列讨论:
CRISPR应用
基于NHEJ的基因破坏 - NHEJ是一个不断重复剪切-修复的过程,直到一个indel形成,阻止核酶的识别才停止。这种看似破坏型的修复在某些特殊情况下却可以被用于治疗,例如PCSK9的破坏可以释放LDL受体,降低血脂;CCR5的破坏可以制造出抗HIV的T细胞。在CRISPR系统的引导下,NHEJ甚至可以只破会两种allele中的一个。同时,虽然NHEJ的修复结果存在异质性,其范围是可以预测的。这种单次切断DNA(single cut)的方式在应用时也更为简便。
基于HDR的精确修复 - HDR的理念很直接,即改正突变的位点,但实际操作上却面临效率较低等问题。不过,在那些只需要改变一小部分细胞的情形下还是具备应用价值。例如在HT-1小鼠内修复一部分肝细胞的FAH基因,就可以使得这些细胞获得生长优势,从而改变疾病性状。另一种手段是利用HDR插入外源DNA序列,其中最著名的是CAR-T。使用CRISPR编辑从病人体内取出的T细胞,插入目标CAR序列,并将T细胞送回病人体内后,CAR-T携带有新的抗原受体,可以靶向性识别和杀死肿瘤。
大规模DNA编辑 - 有些疾病的患者在特定基因上存在大量突变,或是当突变有很强的异质性时,例如杜氏肌营养不良症(DMD),此时可以利用基因编辑系统将携带突变的外显子片段整个切除并替换。而其中Cas9和guide RNA的递送都可以用AAV载体完成。
RNA靶向治疗 - 理论上,靶向RNA的编辑具有可逆性的优势。而Cas13等蛋白则较传统的RNAi特异性更强(专家点评Cell丨杨辉/周海波等利用CasRx在神经性疾病治疗领域取得重大进展;专家点评丨杨辉/黄鹏羽合作组首次证实Cas13d系统在成体动物体内具有靶向沉默RNA的活性)。在肿瘤内不断递送针对KRAS的guide RNA被证明可以减缓小鼠肿瘤生长。AAV同样可以递送Cas13系统。
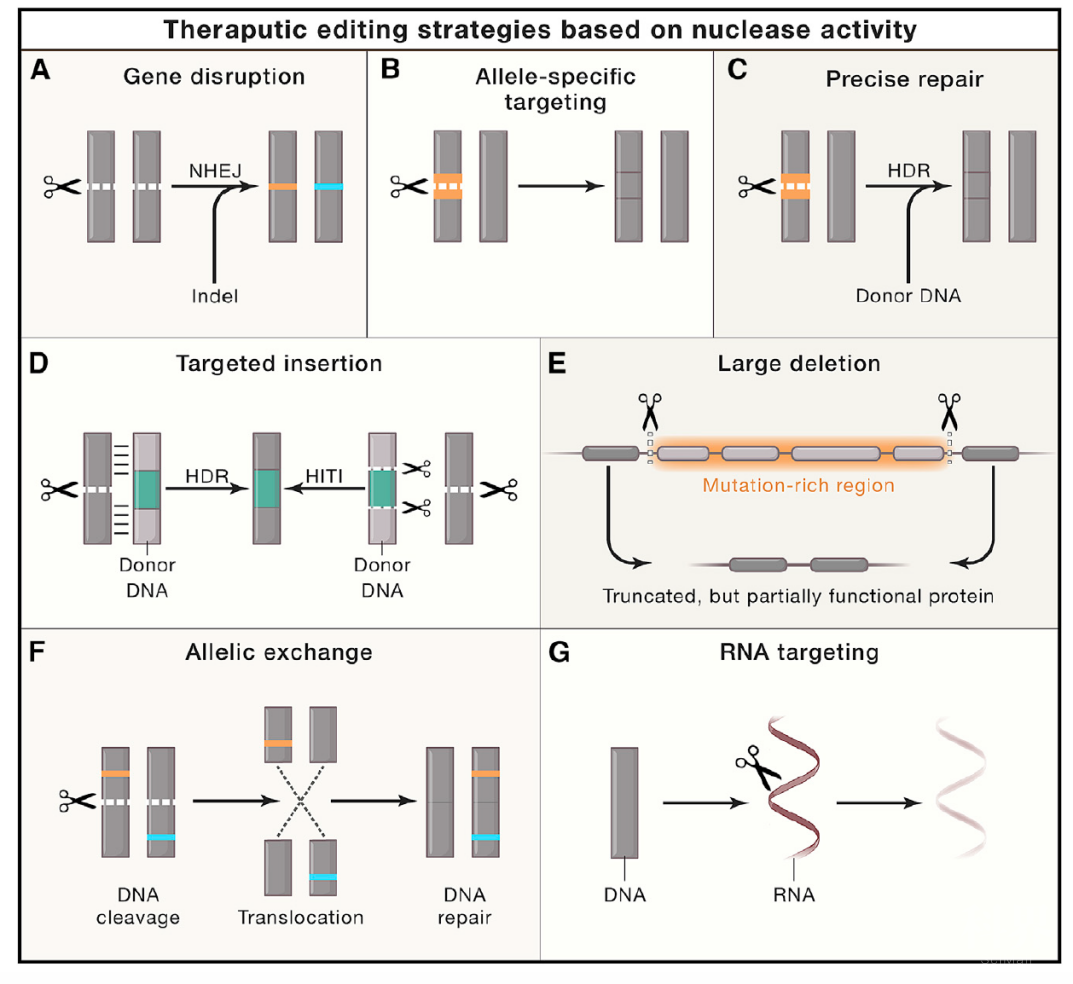
Cas-效应蛋白融合体系 - 除了基因编辑之外,Cas9还可以被当作一个DNA结合蛋白使用,构建CRISPRi/a的基因干扰或激活系统。将dCas9与KRAB融合可以显著抑制目标基因表达,有时甚至比基因破坏更有效。同样,dCas9-VP64也能上调基因表达。将dCas9与甲基化或去甲基化酶结合可以改变表观修饰。此外base editing和prime editing也是修复单碱基或小范围基因突变的有效手段。
AAV载体递送
ex vivo/in vivo - ex vivo是指基因编辑发生在分离到体外的细胞上,编辑后将扩增的细胞重新植入人体。ex vivo方法的主要优势在于,体外基因编辑技术已经非常成熟了。在体外也更容易对基因编辑的结果进行筛查。在体外操作还可以避免免疫系统对基因编辑的排异反应。然而主要的问题在于,可以使用ex vivo方法操作的人体细胞种类太少了,且大都是终端分化的细胞,因此in vivo的方法是必不可少的。而in vivo非常依赖于一个安全的递送系统。AAV载体已经在多个模型上获得成功,其在CEP290基因编辑上的应用已经进入到临床实验阶段。
AAV载体并不大,总长度上限约为5kb,其中可留给CRISPR工具的大小约为4.7kb。这对Cas蛋白造成了很大的限制。人们通过寻找更小的Cas9蛋白来解决这个问题。但是上文提及的Cas-效应蛋白融合系统需要更大的容量。这是AAV基因治疗领域的长期问题。通常的解决方法是将这些蛋白分别包装在两个AAV载体上,使其通过同源重组完成重构。重组的过程可以发生在DNA、RNA或是蛋白水平上。
人们在应用CRIPSR做基因编辑的同时也希望对潜在的不利结果进行控制。一种方法是构造可诱导的表达体系,例如药物诱导、光激活等等。另外一种则是通过构造可自我切除的AAV-CRISPR系统来达到暂时性改变基因表达的目的。此外,还可以利用不同组织携带的不同miRNA来控制CRIPSR系统在人体内的空间分布。
AAV-CRISPR系统和传统基因治疗手段面临着相同的障碍,例如宿主免疫反应,递送效率和载体构建等。此外Cas蛋白的独特性也带来了特殊的安全风险。拖靶效应也是人们在讨论CRISPR的优势时同时会提起的问题。然而总的来说,CRISPR和AAV为如何利用自然系统作为生物工具提供了极好的例子。对AAV-CRISPR系统进行进一步研究和仔细的临床观察在未来会产生更多治疗机会。
来源:brainnews brainnews
原文链接:https://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649573876&idx=5&sn=cd5ebcad853aa4f5851326c753580aff&chksm=f2edaf00c59a2616460f78c67b97c477906490164f27930f5b2c28b14bfb2a6a366f06353603#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



