来源:brainnews
1,运动学习可使新生和存活的少突胶质细胞促进髓鞘再成
少突胶质细胞在中枢神经系统中形成髓鞘,通过代谢耦合增强动作电位的传播,支持神经元和轴突的完整性。少突胶质细胞的损伤严重影响轴突健康,并与多发性硬化症(multiple sclerosis,MS)患者的严重神经功能障碍有关。虽然有越来越多的免疫疗法能够减少多发性硬化症发作的频率,但并不能完全防止轴突退化或功能障碍的累积。少突细胞前体细胞(OPCs)可产生新的少突胶质细胞,具有髓鞘再生的能力,进而恢复神经元功能。然而,MS患者的髓鞘再生通常是不完全的。虽然目前的理论认为成熟的少突胶质细胞不参与髓鞘再生,但最近从脱髓鞘损伤的动物模型中获得的证据表明,已经形成了髓鞘的少突胶质细胞可能产生新的髓鞘。此外,神经元活动可以通过调节节间长度和厚度来改变髓鞘,这增加了成熟少突胶质细胞改变髓鞘形成的可能性。总之,这些发现表明脱髓鞘损伤后,内源性机制的存在可能通过新生和存活的少突胶质细胞调节髓鞘修复。在这项研究中,作者发现了在健康的和髓鞘再生的大脑中,学习塑造髓鞘形成的模式。为了研究运动皮层中运动技能和少突胶质细胞之间的复杂动态关系,作者在小鼠学习“前肢伸展任务”过程中对前肢运动皮层进行双光子纵向成像,发现学习短暂地抑制了少突胶质细胞生成,但随后增加了少突胶质细胞的生成、OPC分化和已有髓鞘的减少。
前肢伸展训练可以调节少突细胞发生和已有髓鞘的重塑
作者使用cuprizone介导的脱髓鞘模型在发育和再脱髓鞘两种情况下研究了以上问题,该模型导致持续的少突胶质细胞死亡和再生,类似于多发性硬化症患者的皮层病变,但没有自体免疫的混乱。作者发现,运动学习在适当的时机可以增强损伤后的少突细胞生成,并通过生成新的髓鞘招募成熟的少突细胞参与髓鞘再生。此外,运动学习通过生成新的髓鞘来增强存活的少突胶质细胞参与髓鞘再生的能力。这些结果表明,运动学习可以通过皮质少突细胞发生和存活的少突细胞形成髓鞘来改善髓鞘再生。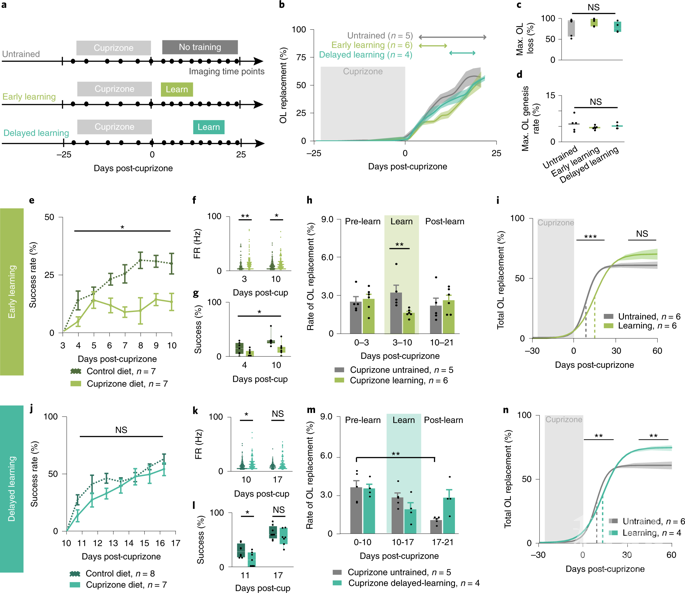
运动学习以时间依赖的方式调节脱髓鞘后的少突细胞发生。
总的来说,作者的研究结果表明,促进少突胶质细胞发生和使成熟少突胶质细胞参与髓鞘修复的特定时间干预治疗,可能会促进脱髓鞘疾病的髓鞘再生,并加速功能恢复。2,通过抑制小胶质细胞Tak1,逆转长期肥胖相关的脑血管功能障碍
肥胖,特别是长期肥胖,通常与血管系统的结构和功能改变有关,如管壁增厚、纤维组织增厚、血管内皮功能障碍。这些病理变化的主要特点是一氧化氮的生物利用度降低,内皮依赖性扩张反应减弱。
越来越多的证据表明,内皮功能障碍在动脉粥样硬化和其他心血管疾病(包括高血压、冠心病和心力衰竭)的发病机制中发挥着重要作用。同样,颈动脉内膜-中膜厚度的增加是亚临床动脉粥样硬化的一个标志,用以评估心血管功能。
虽然目前的研究往往集中在冠状动脉和外周动脉,但我们对肥胖如何影响脑血管功能的认识还很欠缺。在本研究中,我们发现肥胖不仅与外周组织慢性低程度的炎症有关,还与中枢神经系统(如下丘脑)有关。
最近的研究表明,动物以及人类下丘脑中的小胶质细胞和星形胶质细胞,在饮食诱发肥胖的机制和相关代谢综合征中起着至关重要的作用。同时,属于Map3k家族的TGF-β激活激酶1 (TGF-β-activated kinase 1,Tak1)在先天和适应性免疫中起着重要的作用。
我们使用了一种伴随基底动脉(basilar artery,BA)异常的长期肥胖小鼠模型,研究了长期肥胖的病理生理条件,发现长期饮食肥胖会导致小胶质细胞Tak1过度激活,尤其是在脑干中(直接参与心血管功能调节的区域)。
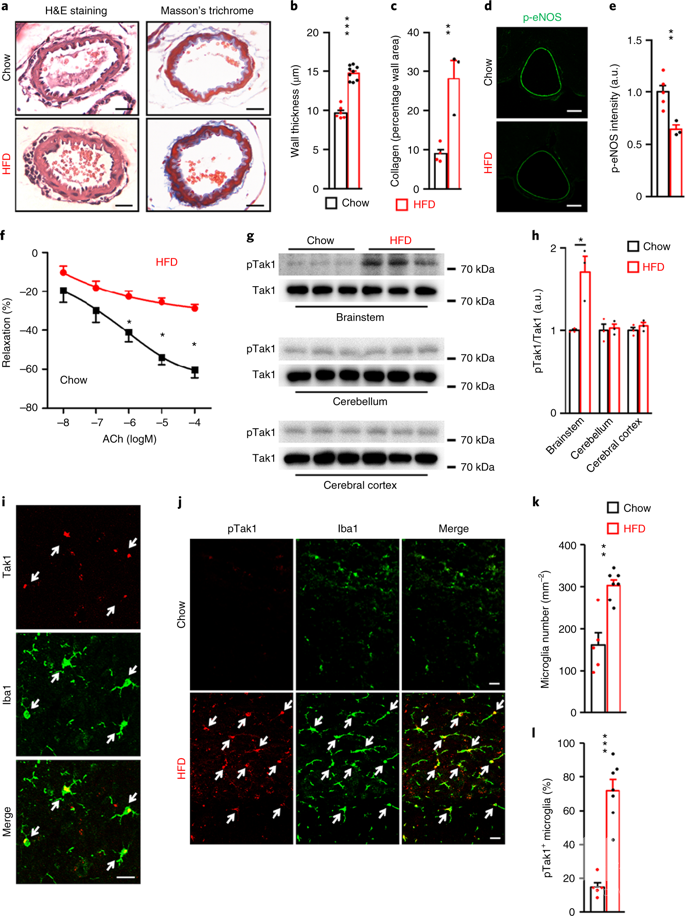
肥胖小鼠脑干小胶质细胞基底动脉的血管功能障碍及Tak1的激活。
在脑干中用药物抑制Tak1或选择删除小胶质细胞Tak1可以改善BA血管功能障碍。相反地,特异性激活脑干中小胶质细胞的Tak1足以导致正常饮食小鼠BA功能受损。并且,我们证明了延长高脂饮食喂养时间会导致小胶质细胞诱发的脑血管功能障碍,而脑干中Tak1的激活在这一过程中起着特殊的作用。
机制上,Tak1的激活导致白细胞介素-18 (IL-18)的生成增加,然而尽管肥胖的时间延长,拮抗大脑中IL-18受体依然有助于防止脑血管功能障碍。Tak1的小胶质细胞选择性缺失也可以防止长时间肥胖的缺血性中风。
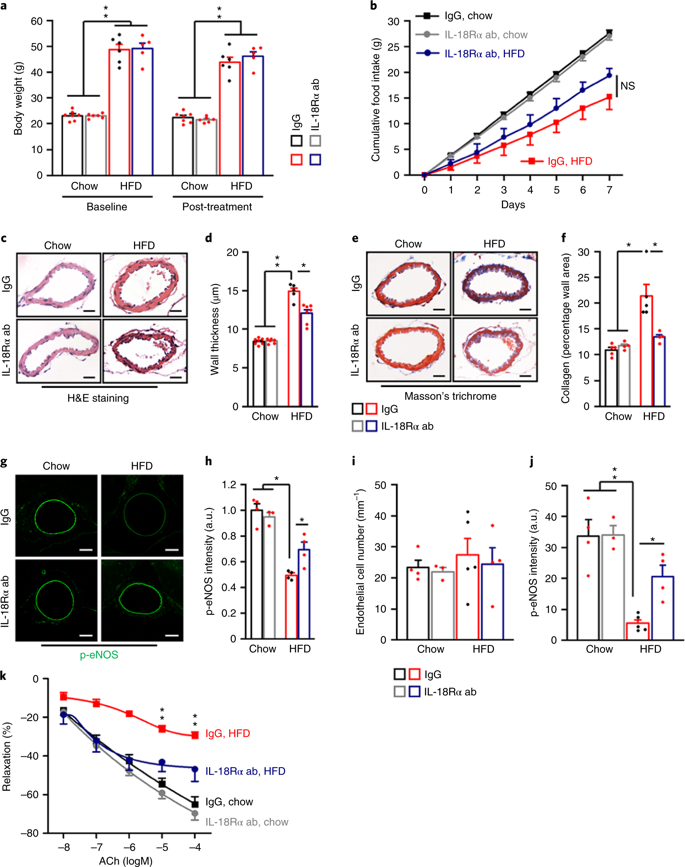
在肥胖小鼠大脑内拮抗IL-18Rα改善血管功能障碍。
综上所述,这些发现证明,大脑中尤其是脑干中的小胶质细胞Tak1,参与了肥胖相关的脑血管功能障碍的发病机制。
来源:brainnews brainnews
原文链接:https://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649573838&idx=1&sn=7037cbde6df44a0fde9d6e8320ab40b1&chksm=f2edaf3ac59a262c6e75d224f01d04906d78265d1a9b5cc69a58443269c9b8913bf836b28643#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


