来源:X一MOL资讯
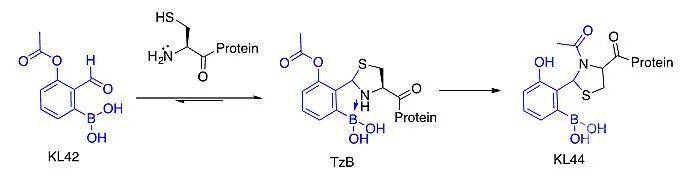
精准的蛋白质化学修饰是近年来化学生物学领域的研究热点之一。蛋白质的定点修饰可以调控或改变蛋白质的性质和功能,对构建抗体药物偶联物也极具意义。近日,波士顿学院高建民教授实验室利用酰基迁移反应高效抑制了临-醛基苯硼酸和半胱氨酸的可逆反应,实现了N端半胱氨酸的多肽、蛋白质、噬菌体的快速、精准化学修饰。此反应基于该组已报道的工作(Chem. Sci., 2016, 7, 4589):临-醛基苯硼酸在水溶液中可以快速地与N端半胱氨酸反应形成四氢噻唑,该五元环被氮-硼配位键稳定形成一个多环产物TzB。此反应具有速度快、选择性好、可逆等特点。近期取得新进展,在此反应基础上增加了一步酰基迁移便可将其转化为一个不可逆的反应,显著提高反应的稳定性,进而扩大其应用范围,并且新的反应继承了原反应速度快、选择性好等优点。
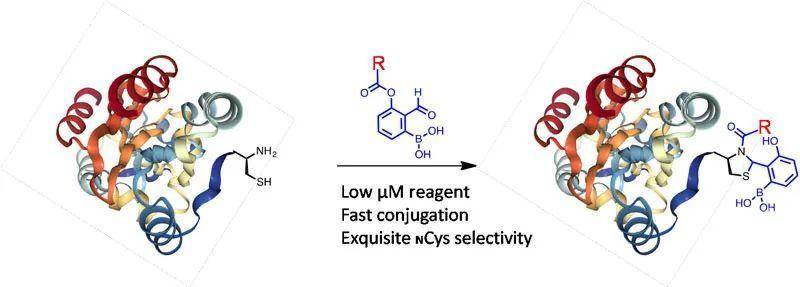
作者进一步将此反应用于更复杂的蛋白质上,令人激动的是,在两小时内1当量的KL42可以高效的修饰带有N端半胱氨酸残基的偶氮还原酶或硫氧还蛋白(10 µM),并且不影响它们的活性。此外,连有生物素的KL42衍生物KL72可以有效地生物素化蛋白质并使其与链霉亲和素结合。
这一成果被发表在Angew. Chem. Int. Ed.上,李开成博士和王文荐为并列一作,高建民教授为通讯作者。
原文:Fast and Stable N-Terminal Cysteine Modification via Thiazolidino Boronate Mediated Acyl TransferKaicheng Li, Wenjian Wang, Jianmin GaoAngew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202000837
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657638388&idx=6&sn=8ec80c0c9288a41d6f5ba20c28a818e7&chksm=80f87e24b78ff732844a6e0f86e8136410fe1400c3d5494b05cf49662e0e77ed2cd304ca073f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



