来源:中国生物化学与分子生物学会
2019年12月,在武汉出现了不明原因的发热和肺炎病人,通过病原鉴定和基因序列分析,证实这是一种从未出现过的新型冠状病毒。全基因组测序与系统发育学分析显示,新型冠状病毒与一种蝙蝠冠状病毒CoV-RaTG13的同源性高达96.3%,与曾经暴发过的严重急性呼吸道综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)基因组的同源性分别为79%和50%,同源性相对较低,但属于同一谱系不同进化枝,具有亲缘关系。2020年2月11日,国际病毒分类委员会(ICTV)正式将新型冠状病毒命名为严重急性呼吸道综合征冠状病毒2型(SARS-CoV-2)。世界卫生组织(WHO)将由该病毒引起的感染疾病命名为2019冠状病毒病(COVID-19)。2020年3月11日,世界卫生组织宣布新冠肺炎进入“全球大流行”(global pandemic)。至2020年4月6日,全球已累计感染超127万例,死亡病例达6.9万例。
01
新发传染病伴随着人类活动,从未走远过
流感、禽流感、SARS、MERS、Ebola、COVID-19,一连串听起来很炫的名字,它们都属于一类共同的疾病——新发传染病(Emerging Infection Disease ),是指以前从未出现过的新的传染病,由新发的病毒、细菌、真菌、寄生虫等病原微生物引起。人类的发展史就是一部与传染病做斗争的历史!自20世纪以来,引起全球性广泛流行的新发传染病,包括1918年西班牙流感、2003年的传染性非典型肺炎(SARS)、2009年的甲型H1N1流感、2011年的中东呼吸综合征(MERS)、2013年的H7N9禽流感、2014-2015年西非暴发的埃博拉病毒感染以及本次新型冠状病毒大流行。21世纪以来,世界卫生组织发布全球大流行的只有2009的甲型H1N1流感和本次新型冠状病毒感染。
研究证明,大约70%的新发传染病来自于野生动物。以流感为例,流感病毒的自然宿主是野生的水禽或候鸟,禽流感病毒在野生动物间传播流行,由于种属屏障的阻隔,一般不感染人类。但是由于人类活动的加剧,养殖业、农贸市场的发展,使野生动物与家禽、人类的接触成为十分普遍的现象。这些禽类病毒在环境中重组突变,可以发生跨种传播,从野禽到家禽或家畜再传给人,并可发生人传人。2009的甲型H1N1流感之所以一开始被称为猪流感,是因为流感病毒从候鸟或野禽,通过家禽传播到猪。禽的呼吸道上皮细胞唾液酸受体糖链结构是α2,3型,人的呼吸道上皮细胞唾液酸受体是α2,6型,所以禽流感病毒一般不会直接传染给人,但是猪的呼吸道上皮同时具有α2,3和α2,6型,因此,猪可作为中间宿主(或称为混合器),重组成熟的禽类病毒就可以向人类传播。冠状病毒也是如此,已有的研究揭示,SARS冠状病毒的自然宿主是蝙蝠,可能是传播蝙蝠传播给了农贸市场里贩售的果子狸,再从果子狸向人类传播。中东冠状病毒MERS也是由蝙蝠传播给中间宿主单峰驼,人通过接触单峰驼而被感染。新型冠状病毒的传染源和传播链存在争论,但据最新的研究认为穿山甲等野生动物可能是中间宿主。
02
冠状病毒,拥有美丽名字的可怕“敌人”
冠状病毒的刺突蛋白也就是S蛋白,呈一个细长的突起,覆盖病毒的球形表面,在电子显微镜下呈现出一个类似“王冠”的形态,故而命名。根据基因型和血清型不同,冠状病毒可分为α、β、γ和δ四个属,其中β冠状病毒又可进一步分为4个独立的亚群,即A、B、C、D亚群。新型冠状病毒属于β冠状病毒属,沙贝病毒亚属(Sarbecovirus),是一种正链RNA病毒,其基因组包含了29891个核苷酸序列,共编码9860个氨基酸,是已知的基因组最长的正链RNA病毒。其基因组编码4种或5种结构蛋白,分别为刺突蛋白(S)、膜蛋白(M)、核衣壳蛋白(N)、血凝素酯酶蛋白(HE,仅见于β冠状病毒)和包膜蛋白(E)。S蛋白是新型冠状病毒最主要的抗原表位,刺激中和抗体的产生,也是疫苗设计的靶位。
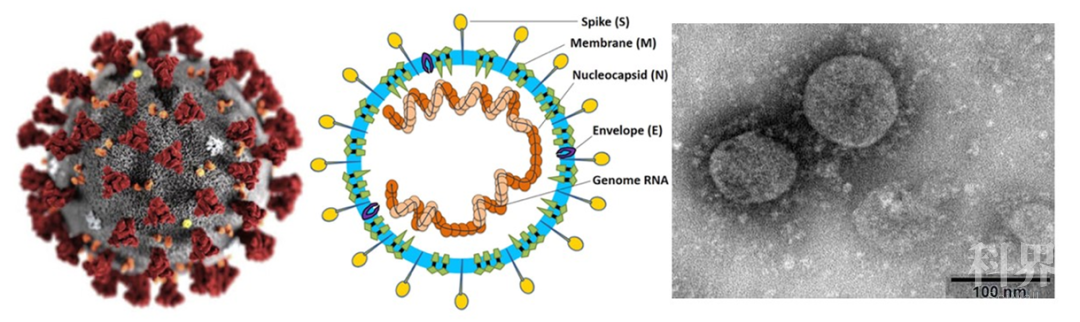
图:冠状病毒外观(左)、结构(中)和电子显微成像(右)
(注:图片资料来自于网络)
冠状病毒具有广泛的天然宿主,可感染人类、哺乳动物、禽类和其他动物。人类易感的是α和β属冠状病毒。已知有6种冠状病毒被证实可引起人类疾病,其中HCoV-229E、HCoV-NL63、HCoV-HKU1和HCoV-OC43通常引起普通感冒样症状,症状较轻微。而SARS 和MERS则可以引起严重的肺炎,甚至致死。本次新型冠状病毒与SARS 和MERS相比,又有明显的不同和显著的特征。病毒培养发现,SARS-CoV-2的传播力显著强于SARS 和MERS,并且体现出了对多种细胞的广泛嗜性。先前的研究证实,SARS-Cov通过病毒包膜上的受体结合蛋白的S1蛋白刺突受体结构域与靶细胞表面血管紧张素转换酶2(ACE2)受体结合并进入细胞。在肺部,ACE2主要表达在I型和II型肺泡上皮细胞表面,约83%的II肺泡细胞可表达ACE2。SARS-CoV-2与此类似,也以人类细胞表面的ACE2作为主要受体,通过呼吸道上皮细胞进入肺部进行复制增殖。由于ACE2广泛表达于食管上部、层状上皮细胞、回肠和结肠吸收性肠上皮细胞表面,提示SARS-Cov-2可以在消化道细胞中存活。研究表明,SARS-Cov-2对受体的结合能力是SARS-Cov的10-20倍,这与其受体结合蛋白中有突变的关键氨基酸残基有关。上述研究是SARS-Cov-2具有极强传播力的物质基础。因此,虽然SARS-Cov-2致死率相对较低(目前报导为3.4%),不及SARS(10%)和MERS(37%),但是由于极强的传播力,已导致全球200多个国家127万人的感染,成为20世纪以来迄今为止最大的全球公共卫生事件。
03
核酸检测,新冠病毒感染的病原学确诊
SARS-Cov-2感染初期症状不典型,与流感类似,主要表现为发热、干咳、咽痛,少数人伴有肌肉酸痛等症状,患者甄别和确诊的依据主要依赖于病毒核酸检测。目前主要采用实时荧光定量PCR技术,针对病毒的特异性基因,包括开放读码框1ab(ORF1ab)、核壳蛋白(N)、包膜蛋白(E)基因等进行确认。标本类型主要是呼吸道标本,包括上呼吸道鼻咽拭子以及下呼吸道标本痰液和肺泡灌洗液等。在疾病初期,上呼吸道样本可以检出阳性,但由于该病毒嗜肺,在肺中增殖,因此,发病以后下呼吸道标本阳性率高。我们摸索出一种新的样本采集方式,即做深咳3-5次动作,尽力把病毒从气道咳出,收集唾液,检测效果接近痰液,而且方便安全。
冠状病毒(SARS-Cov-2,SARS,MERS)具有一个共同特点,病毒释放高峰(peak of viral shedding)在发病以后5天左右,并非感染初期。因此会出现部分患者的流行病学、临床表现、影像学高度疑似,而呼吸道核酸检测阴性而难以确诊的情况。针对这种情况,持续监测和在合适时机采集下呼吸道样本有利于提高阳性率。影像学发现证明,SARS-Cov-2感染主要累计双下肺深部以及肺的外带,以间质性病变为主,感染部位离气道相对较远。患者表现为少痰、干咳为主,也导致气道排毒的高度不均一性。所以,核酸检测结果出现时阴时阳的现象是与上述感染特征相关的。目前国家指南的出院标准中,病原学依据是间隔24小时2次核酸检测阴性,但也发现,出院以后随访病人中,少部分病人中依然可检测到核酸阳性,这不应轻易理解为再感染,更大的可能是恢复期的间歇性排毒。流感患者中也是如此,在流感恢复期,部分患者仍然可以检测到核酸阳性,这都是同一个道理。因此,对恢复期人群的隔离管理很重要。
核酸检测是病原确诊的最主要依据,但也面临着技术上的挑战。目前采用的实时荧光定量PCR,尽管可靠性良好,但是速度太慢,对每一个标本的测试至少需要4小时。针对这样大规模暴发的传染病,显然远远不能满足疾控和诊疗的需求,也是成为完成“应测尽测”任务的瓶颈。目前在全球体外诊断领域,正在研发和推出快速的核酸诊断技术,包括样本处理和核酸提取过程的简化、快速核酸扩增技术的应用等。相信在不久的将来,半小时以内实现结果报告、完全封闭的甚至是可抛弃的一次性使用的核酸快速检测技术会推向市场。这些技术,最适合应用于基层诊所和发热门诊,将极大地推进新发感染的及早发现和防控的关口前移。
现在市场上宣传的“一滴血可以诊断新冠病毒”,是指检测SARS-Cov-2感染后的特异性抗体,包括IgG和IgM。理论上讲,SARS-Cov-2感染以后,机体可以产生新冠病毒特异性抗体。但是,目前所有的研究报导证实,即使是作为急性感染证据的IgM抗体也都是在感染后1周甚至10天后才产生,IgG抗体延后2-3天产生。因此特异性抗体缺乏早期诊断价值,无法代替病毒的核酸检测。而且,抗体的产生跟机体免疫能力有关,部分免疫低下患者(肿瘤、尿毒症等)可以不产生或者仅产生极低水平的抗体。抗体检测可以作为核酸检测阴性的高度疑似患者的补充诊断依据,或者作为流行病学调查的依据。至于未感染的密切接触人群中特异性抗体的存在情况,则有待系统调查和研究。目前来看,至少在密切防护的医务人员当中,很少发现有特异性抗体阳性。这些资料将为易感人群的保护和疫苗策略提供依据。
04
追踪溯源,新冠病毒的传播方式和日常防护
研究显示,SARS-Cov-2主要通过飞沫、接触、粪口等途径传播。SARS-Cov-2感染的患者往往有剧烈的咳嗽(干咳为主),通过咳嗽大量排毒。病毒在空气中可以存活约2小时,近距离(1.5米之内)可以通过飞沫引起有效传播。因此,在流行季节保持有效的距离、佩戴口罩,是防止感染的有效措施。除了气道传播,值得注意的是密切接触传播。多项研究证明,患者剧烈咳嗽后,唾液中存在大量病毒。因此,共用餐具是不容忽视的传播方式。
我们的研究发现,新型冠状病毒不仅可以存在呼吸道中,也在粪便、血液、尿液,甚至泪液中都可以检测到病毒核酸。尤其是在粪便中,核酸可以出现强阳性,而且在粪便中培养到了病毒。进一步研究发现,新型冠状病毒可在肠道上皮细胞中弱增殖,因此粪便的传染性是肯定的。我们推测,粪便中的病毒,主要是患者通过吞咽动作,因痰液和唾液的包裹,抵抗胃酸中和进入肠道,并可在肠道长期存活。这也可以解释患者在出院前呼吸道样本核酸阴性了,但粪便核酸仍然阳性的原因。我们的研究发现粪便核酸阳性平均持续时间为21天,要长于呼吸道持续时间19天。粪便中的上述研究发现,为粪口传播提供了有力证据。SARS-Cov-2上述传播特征,也可以作为本次传染病以家庭聚集性和密切接触的医务人员感染为主的解释依据。
有报道说在血液、尿液甚至泪液中检出核酸阳性,但从目前证据来看,核酸结果都呈弱阳性,也没有培养出病毒。通过这些部位传播的可能性存在,但风险相对较小。母婴传播是大家关注的焦点之一,但目前已有的证据并不支持母婴传播。
必须重视潜伏期感染。目前资料显示COVID-19的潜伏期约5天,最长者可达20余天,潜伏期感染增加了传播风险,因此对潜伏期和无症状感染者的早期识别和发现对于有效控制病毒传播具有重要意义。
另外,研究发现,SARS-Cov-2可以在墙壁、家具、地表、马桶等物体表面存活超过72小时,在污水中也可以长期存在,这些都成为密切接触传播的源头。所以提倡在流行季节戴口罩、保持有效社交距离,以及勤洗手、分餐制和远离野生动物等文明行为,都是行之有效的日常防控手段。
作者:陈瑜 博士,博士生导师

浙江大学医学院附属第一医院检验中心主任,浙江大学检验医学研究所所长,浙江省临床体外诊断技术研究重点实验室主任,传染病诊治国家重点实验室副主任。国家“万人计划”科技创新领军人才。中国医师协会检验医师分会常委,浙江省生物化学与分子生物学学会理事,中华医学会检验分会委员,浙江省检验学会主任委员。主要研究方向:感染性疾病发病机制研究及新型实验诊断技术研发。主持国家重大专项、国家973、863以及国家自然基金等课题18项,获国家科技进步一等奖、中华医学科技奖一等奖、教育部技术发明二等奖等7项。在国际顶级期刊《柳叶刀》等发表SCI论文120余篇,获国家发明专利14项,主编参编专著19部。
参考文献

封面图来源:Pexels
来源:csbmb_since1979 中国生物化学与分子生物学会
原文链接:https://mp.weixin.qq.com/s?__biz=MzAxMjUxNTI2Nw==&mid=2649369939&idx=1&sn=ebe737f589e00bef80b334ac6aef4710&chksm=83ae2fffb4d9a6e9b4ad86730fa91ee02f99691b3d708d8d1e285083cf1be1d72f5bdc36c64a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
