来源:中国医学科学院医学信息研究所
DNA损伤对基因组稳定性构成了重大威胁,因此细胞进化出多种机制来保护其基因组完整性,这些机制统称为DNA损伤反应(DNA damage response,DDR)。在不同类型的损伤中,DNA双链断裂(double-strand breaks,DSBs)是最严重的DNA损伤类型之一。DSB主要通过两种途径进行修复:同源重组(homologous recombination,HR)和非同源末端连接(non-homologous end-joining,NHEJ)。同时,非同源末端连接(NHEJ)还参与抗体类别转换重排(class-switch recombination,CSR),功能障碍端粒融合以及染色体内断裂修复。因此,NHEJ的发生和NHEJ的精细调控对于机体而言至关重要。同源重组修复(HR)以姐妹染色单体的同源序列为模板进行,依赖于核酸酶对DNA末端切除(rep),产生一长段RPA包裹的单链DNA。非同源末端连接(NHEJ)则不需要模板直接进行末端连接修复,因此必须要抑制DNA末端切除的进行,才能确保NHEJ的顺利进行,而DNA末端切除的抑制机制一直是个悬而未决的科学问题。最近多个课题组报道shieldin复合物是位于DNA损伤修复反应53BP1-RIF1通路下游的效应因子,它可以直接结合双链断裂后产生的单链DNA末端,抑制其末端切除,促进NHEJ的转换进行。然而,shieldin复合物的具体组装机制目前尚不清楚。2020年4月24日,北京大学系统生物医学研究所尹玉新团队在Nature Communications发表了题为:Molecular basis for assembly of the shieldin complex and its implications for NHEJ 的研究论文,首次阐释了shieldin复合物的组装机制及其对NHEJ过程的影响。 此研究开始就面临一个重要的难题—如何制备均一的三元复合物,与既往针对REV7的研究不同,研究团队通过对复合物进行大量的生化鉴定,发现只有使用野生型的REV7才能制备均一稳定的SHLD3-REV7-SHLD2三元复合物,随后得到了复合物晶体,在上海光源BL18U1收集了衍射数据,成功解析了高分辨率的三元复合物晶体结构。出乎意料的是,此复合物中SHLD3、REV7和SHLD2三者的比例为1:2:1,并且REV7存在关闭(C-REV7)和开放(O-REV7)两种不同的状态,形成C-REV7-O-REV7构象二聚体。进一步实验证实,O-REV7对于shieldin复合物的组装必不可少,构象二聚体界面的关键氨基酸残基的突变可以完全打破两者之间的相互作用并且显著影响NHEJ效率。这是首次发现REV7能够形成构象二聚体,对正确理解REV7分子的工作机制非常关键。
此研究开始就面临一个重要的难题—如何制备均一的三元复合物,与既往针对REV7的研究不同,研究团队通过对复合物进行大量的生化鉴定,发现只有使用野生型的REV7才能制备均一稳定的SHLD3-REV7-SHLD2三元复合物,随后得到了复合物晶体,在上海光源BL18U1收集了衍射数据,成功解析了高分辨率的三元复合物晶体结构。出乎意料的是,此复合物中SHLD3、REV7和SHLD2三者的比例为1:2:1,并且REV7存在关闭(C-REV7)和开放(O-REV7)两种不同的状态,形成C-REV7-O-REV7构象二聚体。进一步实验证实,O-REV7对于shieldin复合物的组装必不可少,构象二聚体界面的关键氨基酸残基的突变可以完全打破两者之间的相互作用并且显著影响NHEJ效率。这是首次发现REV7能够形成构象二聚体,对正确理解REV7分子的工作机制非常关键。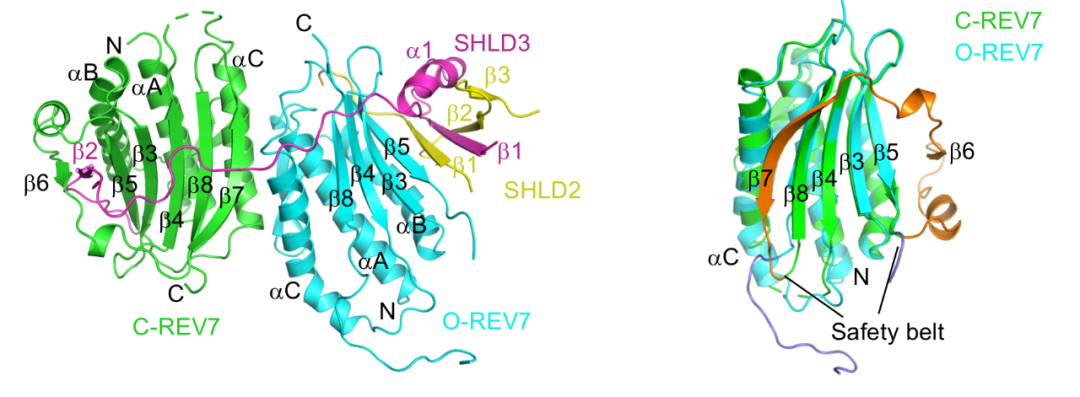 研究人员还发现,SHLD3上非常保守的FXPWFP模体能够结合在C-REV7的表面,这一表面正是跨损伤合成酶REV1结合C-REV7的位置,导致C-REV7只能选择性结合SHLD3或REV1,由此确定了NHEJ和跨损伤合成修复的互斥关系,这为开发新型肿瘤化疗药物提供了理论依据。
研究人员还发现,SHLD3上非常保守的FXPWFP模体能够结合在C-REV7的表面,这一表面正是跨损伤合成酶REV1结合C-REV7的位置,导致C-REV7只能选择性结合SHLD3或REV1,由此确定了NHEJ和跨损伤合成修复的互斥关系,这为开发新型肿瘤化疗药物提供了理论依据。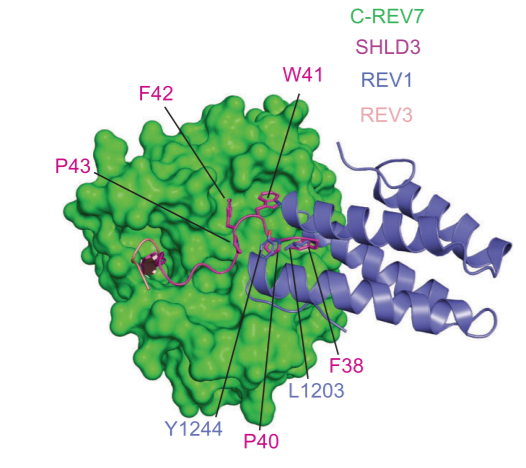
此外,REV7构象二聚体还可能作为平台结合其它DNA修复蛋白分子如REV3。研究人员首次证实在DSBs发生后REV3能够定位到DNA损伤位点,并与REV7构象二聚体发生物理相互作用,促进损伤修复过程。总之,此项研究阐明了在DNA修复过程中shieldin复合物的组装机制,首次证明了REV7构象二聚体的存在和作用,改变了学界对REV7分子存在形式的认识,为制定针对DNA损伤修复的肿瘤靶向治疗和化疗策略提供了全新的思路。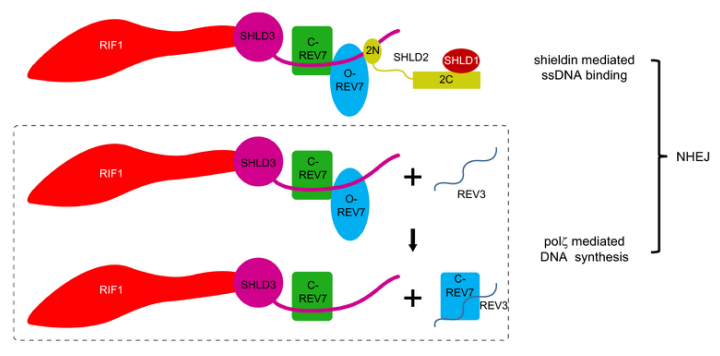 北京大学医学部优博培育计划梁令和冯嘉汶博士为该论文的共同第一作者,北京大学系统生物医学研究所尹玉新教授和梁令博士为共同通讯作者,尹玉新教授长期从事肿瘤系统生物医学研究。该研究得到了上海张江国家蛋白质科学研究设施晶体衍射线站BL18U1和国家蛋白质科学中心凤凰工程的平台支持。本课题的实施得到了北京大学基础医学院王嘉东研究员和云彩红教授的大力支持和帮助,清华大学生命科学学院陈柱成教授以及北京大学物理学院毛有东研究员也给予了指导建议。
北京大学医学部优博培育计划梁令和冯嘉汶博士为该论文的共同第一作者,北京大学系统生物医学研究所尹玉新教授和梁令博士为共同通讯作者,尹玉新教授长期从事肿瘤系统生物医学研究。该研究得到了上海张江国家蛋白质科学研究设施晶体衍射线站BL18U1和国家蛋白质科学中心凤凰工程的平台支持。本课题的实施得到了北京大学基础医学院王嘉东研究员和云彩红教授的大力支持和帮助,清华大学生命科学学院陈柱成教授以及北京大学物理学院毛有东研究员也给予了指导建议。
 北京大学医学部优博培育计划梁令和冯嘉汶博士为该论文的共同第一作者,北京大学系统生物医学研究所尹玉新教授和梁令博士为共同通讯作者,尹玉新教授长期从事肿瘤系统生物医学研究。该研究得到了上海张江国家蛋白质科学研究设施晶体衍射线站BL18U1和国家蛋白质科学中心凤凰工程的平台支持。本课题的实施得到了北京大学基础医学院王嘉东研究员和云彩红教授的大力支持和帮助,清华大学生命科学学院陈柱成教授以及北京大学物理学院毛有东研究员也给予了指导建议。
北京大学医学部优博培育计划梁令和冯嘉汶博士为该论文的共同第一作者,北京大学系统生物医学研究所尹玉新教授和梁令博士为共同通讯作者,尹玉新教授长期从事肿瘤系统生物医学研究。该研究得到了上海张江国家蛋白质科学研究设施晶体衍射线站BL18U1和国家蛋白质科学中心凤凰工程的平台支持。本课题的实施得到了北京大学基础医学院王嘉东研究员和云彩红教授的大力支持和帮助,清华大学生命科学学院陈柱成教授以及北京大学物理学院毛有东研究员也给予了指导建议。原文链接:
https://www.nature.com/articles/s41467-020-15879-5
来源:IMICAMS 中国医学科学院医学信息研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzUxNzc5MzUwNw==&mid=2247486045&idx=1&sn=187419a812b5546b09da22453228eebc&chksm=f993f9d1cee470c75052cf45e7cd985cd67ad35d2f11951a8cbdc753d321b49dbbf5b8d24e27&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn








