来源:BioArt
撰文 | 章台柳
免疫逃逸是肿瘤治疗的主要难题,常见的逃逸机制包括MHC-I突变或杂合性丢失导致抗原呈递过程受损,导致免疫检查点阻断治疗(ICB)的抵抗性【1】。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)对ICB等大多数肿瘤治疗具有抵抗性,虽然PDAC中很少发生导致MHC-I丢失的突变,但MHC-I的表达常常被下调【2】。然而,PDAC中MHC-I表达下调的机制目前尚不清楚。
近日,来自加州大学旧金山分校的RushikaM.Perera和来自纽约大学医学院的Alec C. Kimmelman合作在Nature杂志发表文章Autophagy promotes immune evasion of pancreatic cancer by degrading MHC-I,报道了PDAC中,自噬货物受体蛋白NBR1靶向结合并选择细胞表面的MHC-I分子,通过自噬依赖的溶酶体降解通路下调细胞表面MHC-I。且PDAC的MHC-I主要定位在自噬小体和溶酶体上,而细胞表面MHC-I的表达减少。抑制自噬能够恢复细胞表面MHC-I水平,增加抗原呈递增加和抗肿瘤T细胞反应,减少小鼠的肿瘤生长;而且抑制自噬的抗肿瘤效应依赖于CD8+ T细胞和细胞表面的MHC-I表达。抑制自噬和双ICB治疗(anti-PD1+anti-CTLA4)联用导致显著增强的抗肿瘤免疫反应。

研究人员首先发现人PDAC细胞系中总MHC-I蛋白水平具有异质性,并且具有明显的MHC-I与溶酶体共定位的点状细胞质分布。而未转化的人胰腺导管上皮(human pancreatic ductal epithelial,HPDE)细胞中MHC-I分子主要定位在细胞膜。并且,与HPDE的溶酶体相比,MHC-I分子在PDAC溶酶体上高度富集。溶酶体抑制导致MHC-I在溶酶体的累积,这表明MHC-I到达溶酶体进行降解。大部分的MHC-I点状聚集与LC3B标记的自噬小体共定位,这与PDAC中自噬增加相一致。此外,大部分的PDAC细胞系和全部的人PDAC肿瘤中都明显检测到MHC-I分子在细胞内的定位。敲低ATG3和ATF7抑制自噬或者V-ATPase抑制剂BafA1抑制溶酶体都能增加PDAC细胞中总MHC-I和细胞膜的MHC-I水平,且BafA1或chloroquine抑制溶酶体并不影响其他参与抗原处理和呈递的蛋白。
自噬货物受体蛋白结合并招募底物到自噬小体的膜上,从而实现自噬对靶向分子的选择性降解。研究人员对PDAC中介导MHC-I降解的自噬受体蛋白进行筛选,发现只有NBR1与MHC-I相互作用。免疫荧光显示相比HPDE细胞,PDAC中NBR1与MHC-I的共定位更加频繁。NBR1可与泛素化底物互作并介导其降解,而PDAC中MHC-I被多泛素化修饰。并且敲低NBR1导致PDAC中总MHC-I和细胞膜MHC-I的增加,即PDAC细胞表面的MHC-I是通过NBR1介导的自噬-溶酶体降解通路而降低。此外,PDAC细胞中基础自噬水平影响其免疫原性,自噬水平低的PDAC细胞克隆形成能力降低,形成的肿瘤更小,且MHC-I表达较高,肿瘤浸润CD8+ T细胞更多。
CD8+ T细胞通过识别肿瘤细胞MHC-I呈递的抗原而发挥抗肿瘤免疫反应,那么PDAC细胞表面MHC-I降低是否帮助其逃逸CD8+ T细胞的杀伤,从而对大部分肿瘤治疗具有抵抗性?研究人员构建了可诱导性自噬抑制的PDAC细胞系,发现自噬抑制导致细胞表面MHC-I增加,抗原肽呈递增加。PDAC细胞中诱导自噬抑制导致共培养的CD8+ T细胞增殖增加,IFN-γ和TNF表达增加,同时PDAC活性降低。小鼠的原位肿瘤模型和转移性肿瘤模型显示,自噬抑制的细胞形成肿瘤较小,MHC-I表达更高,PD-L1表达没有变化,并且CD8+ T细胞浸润增加,髓系来源异质性细胞减少。CD103+ DC细胞对激活并招募CD8+ T细胞有重要作用,使用抗体去除CD8+ T细胞或缺失CD103+ DC都能恢复自噬抑制肿瘤的生长。同时自噬抑制肿瘤细胞中MHC-I缺失导致CD8+ T细胞数量减少,恢复肿瘤生长。PDAC对肿瘤治疗具有抵抗性,而自噬抑制的PDAC对双ICB治疗(anti-PD1+anti-CTLA4)响应良好,CD8+ T细胞和PD1+TIM3-细胞浸润增加,即肿瘤细胞中抑制自噬能提高PDAC对双ICB的敏感性。那么,抑制自噬和双ICB联用的治疗方法是否具有临床转化潜能?chloroquine能抑制溶酶体酸化过程,是临床可用的系统性抑制自噬的药物。Chloroquine使用能增加小鼠PDAC肿瘤的表面MHC-I水平,但不能控制肿瘤生长,与双ICB联用能诱发强烈的抗肿瘤免疫、自噬降低、CD8+ T细胞浸润增加。即无论是肿瘤细胞单独或全身性自噬抑制都能提高PDAC肿瘤对双ICB治疗的敏感性。
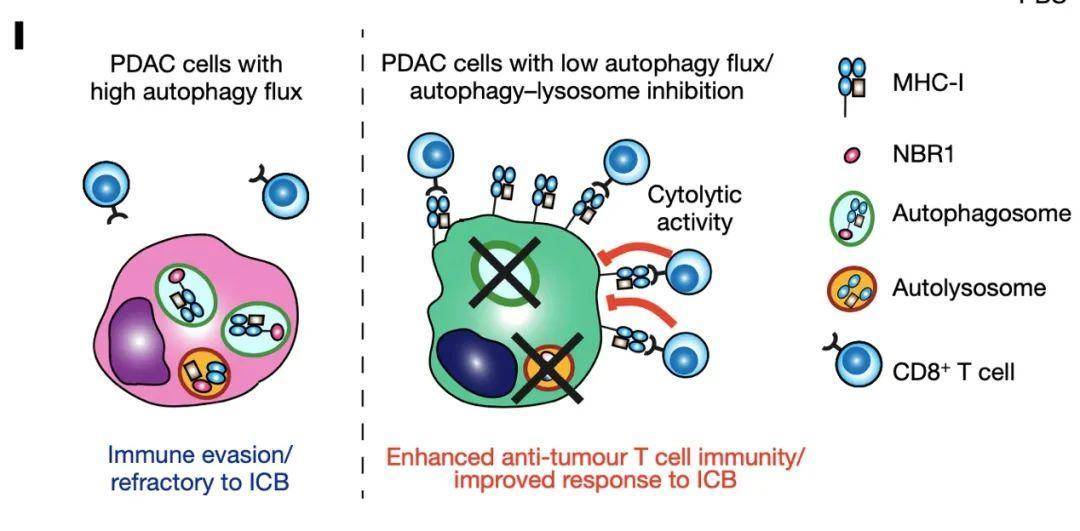
总的来说,研究证明了PDAC中自噬或溶酶体功能增强通过选择性靶向MHC-I分子降解从而实现免疫逃逸,揭示了自噬抑制和双ICB治疗联用或是PDAC的新治疗策略。
参考文献
1. McGranahan, N. et al. Allele-specific HLA loss and immune escape in lung cancer evolution. Cell 171, 1259–1271 (2017).
2. Pandha, H., Rigg, A., John, J. & Lemoine, N. Loss of expression of antigen-presenting molecules in human pancreatic cancer and pancreatic cancer cell lines. Clin. Exp. Immunol. 148, 127–135 (2007).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652483755&idx=3&sn=4df3ca187f47ab3c3fb8b0873f788e37&chksm=84e2231fb395aa0994ce764bcf032aacee33c3e3b929cdf0385c10ad8a9ac927240a06ac0f83#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



