来源:BioWorld
截至2020年4月20日,国内已有三种SARS-CoV-2疫苗获批进入临床试验,其中包括北京科兴生物技术有限公司旗下科兴中维生物技术有限公司开发的的新冠病毒灭活疫苗。4月16日,该疫苗Ⅰ期临床研究已在江苏省徐州市睢宁县启动。据科兴质量管理委员会主席、科兴新冠灭活疫苗研制项目质量与注册负责人公雪杰介绍,Ⅰ期临床试验已有众多志愿者完成接种,初步结果显示疫苗安全性良好。随后志愿者们将在接种后第1、2、3、4、7、30天接受研究人员安全性访视。 2020年4月20日,由中国医学科学院秦川团队领衔,联合北京科兴生物技术有限公司等多家单位合作,在预印本 bioRxiv 上传了题为:Rapid development of an inactivated vaccine for SARS-CoV-2 的研究文章。该研究是SARS-CoV-2灭活病毒疫苗(PiCoVacc)的临床前动物模型的中试(pilot-scale)研究。也是目前为止公开报道的第一个SARS-CoV-2疫苗的动物实验研究结果。

研究发现,PiCoVacc可以在小鼠、大鼠和恒河猴体内诱导出SARS-CoV-2特异性中和抗体。这些抗体能有效中和10个有代表性的SARS-CoV-2毒株,暗示产生的抗体可能对全世界范围内的SARS-CoV-2的中和能力具有广谱作用。进一步的恒河猴攻毒实验表明,在接种3ug时可以起到部分保护作用,接种6ug剂量时可以起到完全的保护效果且没有任何抗体依赖的增强(ADE)作用。通过分析恒河猴的临床体征、血液学和生化指数以及组织病理学结果,表明PiCoVacc是安全可靠的。该动物实验结果支持人SARS-CoV-2疫苗的快速临床开发。
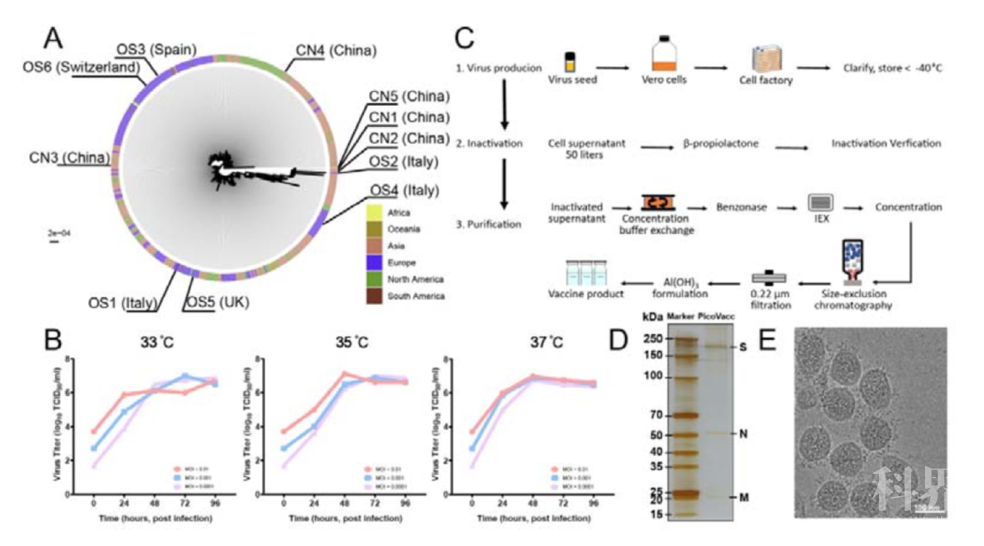 图1. PiCoVacc的开发
图1. PiCoVacc的开发研究者在第0天和第7天给小鼠接种PiCoVacc后,未观察到炎症或其他不良反应。研究者首先检测了免疫原性,结果显示,SARS-CoV-2的S蛋白和RBD特异性的IgG迅速被诱导出来,在第6周达到峰值。其中,RBD特异性的IgG占S蛋白抗体反应的一半,表明RBD是主要的免疫原,这一结果也与恢复期的COVID-19患者的血清学特征相似。值得注意的是,与恢复期COVID-19患者血清相比,PiCoVacc诱导出了更高滴度的S蛋白特异性抗体。接下来,研究者使用微中和测定(MN50)检测SARS-CoV-2特异性中和抗体在一段时间内的水平。结果显示,高剂量免疫的中和抗体在第1周出现,在第2周加强免疫后显著增加,而对照组则未检测到SARS-CoV-2特异性抗体反应。作者随后在大鼠中以及对不同毒株的实验中也得到了相似的结果。
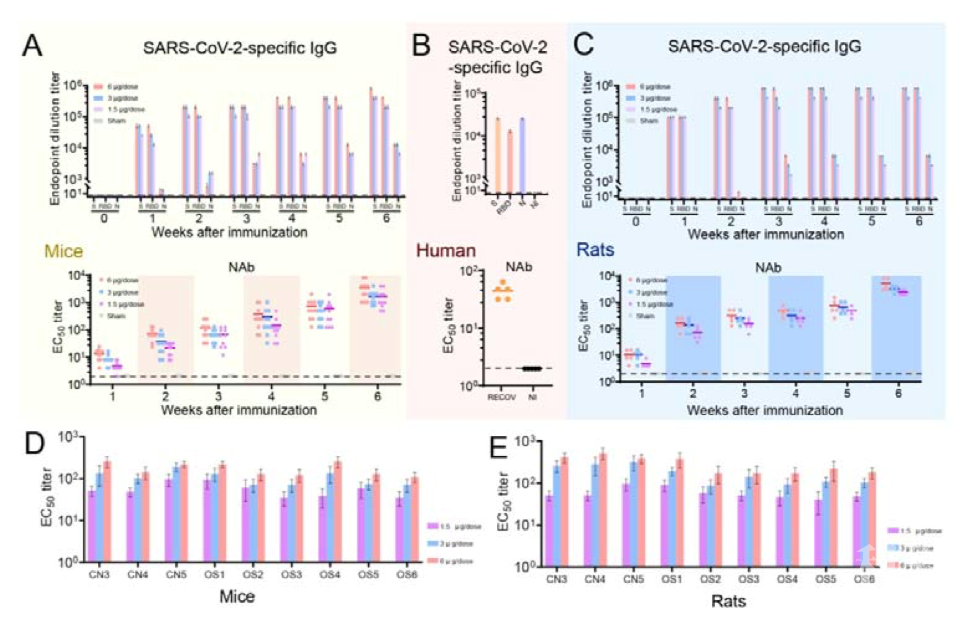 图2. PiCoVacc免疫后的中和抗体反应 随后研究者在恒河猴中进行攻毒实验,首先接种疫苗,在第0、7和14天接种三次两种剂量(3ug和6ug),结果显示,S蛋白的异性的IgG和中和抗体在第2周被诱导出来,并在第3周继续增加。滴度与恢复期的COVID-19患者的血清相似。随后研究者在第22日(第三次免疫后一天)进行攻毒,结果显示,与对照组相比,接种过疫苗的恒河猴病毒肺部组织病理变化显著减小。此外,病毒载量也显著下降,在6ug组感染后第七天,咽喉、肛门和肺部都检测不到病毒。也未发生ADE现象。
图2. PiCoVacc免疫后的中和抗体反应 随后研究者在恒河猴中进行攻毒实验,首先接种疫苗,在第0、7和14天接种三次两种剂量(3ug和6ug),结果显示,S蛋白的异性的IgG和中和抗体在第2周被诱导出来,并在第3周继续增加。滴度与恢复期的COVID-19患者的血清相似。随后研究者在第22日(第三次免疫后一天)进行攻毒,结果显示,与对照组相比,接种过疫苗的恒河猴病毒肺部组织病理变化显著减小。此外,病毒载量也显著下降,在6ug组感染后第七天,咽喉、肛门和肺部都检测不到病毒。也未发生ADE现象。 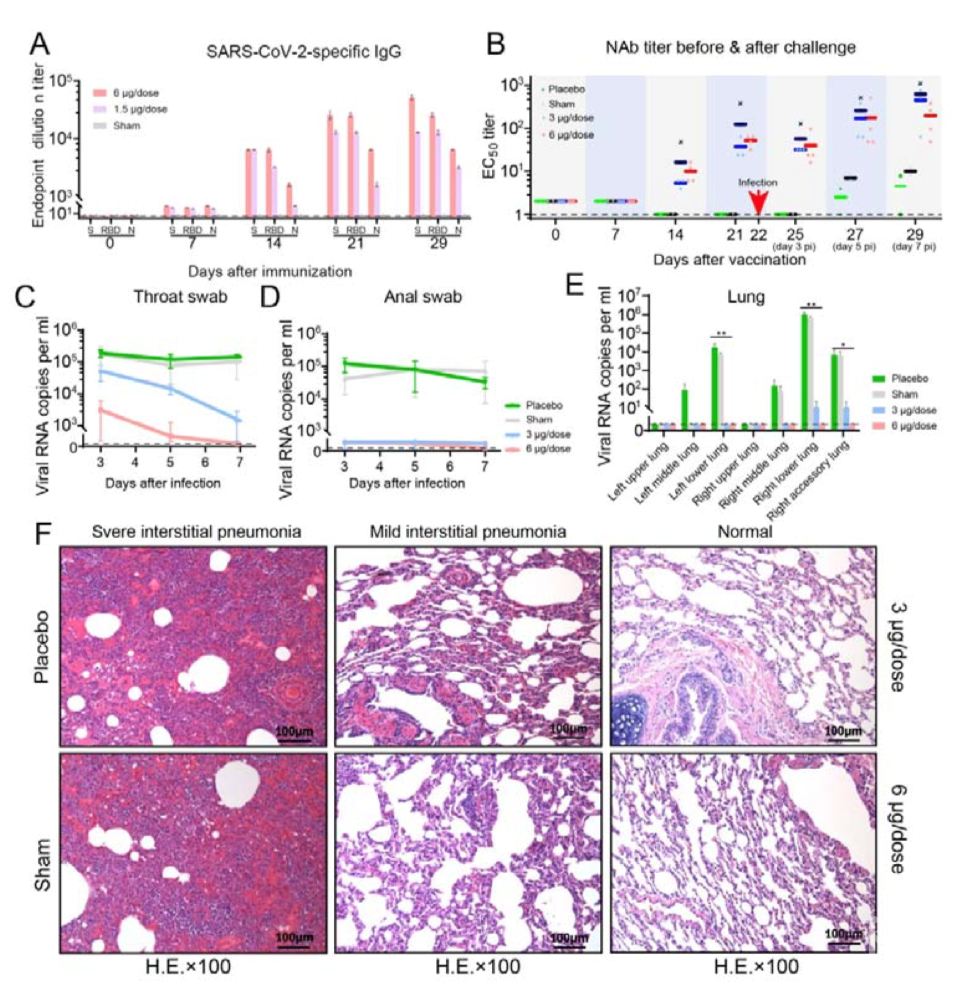 图3. PiCoVacc在恒河猴中的免疫原性和保护效果 接下来,研究者又通过观测临床指标和生化指数验证了该疫苗的安全性,所有接种疫苗的恒河猴均未发现发烧和体重减轻现象,且食欲和精神状态都保持正常。淋巴细胞亚群比例(CD3+、CD4+ 和CD8+)以及关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)表明与对照组相比均没有显著变化。此外,第29天对肺、心、脾、肝、肾和脑在内的各种器官组织的病理学评估表明,PiCoVacc也没有引起显著的病理学特征,以上结果表明了PiCoVacc在恒河猴中具有安全性。
图3. PiCoVacc在恒河猴中的免疫原性和保护效果 接下来,研究者又通过观测临床指标和生化指数验证了该疫苗的安全性,所有接种疫苗的恒河猴均未发现发烧和体重减轻现象,且食欲和精神状态都保持正常。淋巴细胞亚群比例(CD3+、CD4+ 和CD8+)以及关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)表明与对照组相比均没有显著变化。此外,第29天对肺、心、脾、肝、肾和脑在内的各种器官组织的病理学评估表明,PiCoVacc也没有引起显著的病理学特征,以上结果表明了PiCoVacc在恒河猴中具有安全性。 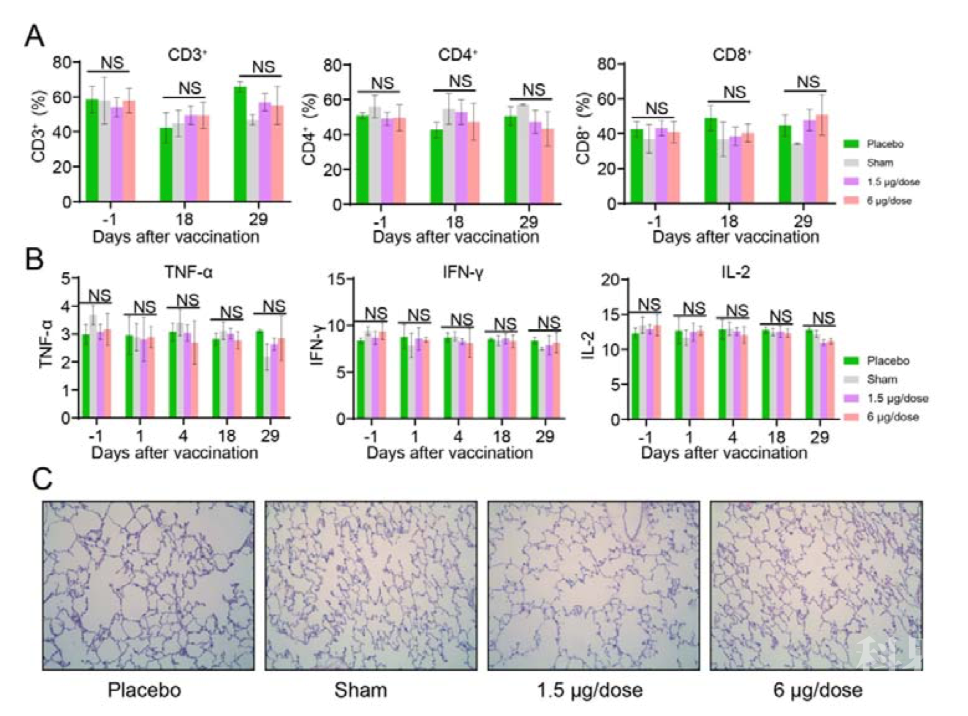 图4. PiCoVacc在恒河猴中的安全性评估 虽然SARS-CoV-2感染的恒河猴模型目前还不完善,但SARS-CoV-2感染的恒河猴引起COVID-19样的症状仍然能够支持研究者对SARS-CoV-2的研究。重要的是,在接种PiCoVacc的恒河猴中没有观察到ADE和免疫病理情况恶化现象。并且接种6ug PiCoVacc的恒河猴可以完全抵御SARS-CoV-2的挑战。这些结果证明了PiCoVacc在恒河猴中的安全性和有效性,共同为人SARS-CoV-2疫苗的临床开发提供了一条前进的道路。 新冠病毒灭活疫苗的I期临床试验已经开始,已有众多志愿者完成接种,初步结果显示疫苗安全性良好。公雪杰表示,在获得Ⅰ期临床有关的安全性数据后,由研究者和伦理委员会批准确定启动Ⅱ期临床研究。目前,此次项目的申办者和研究者已经达成共识,并获得了伦理委员会的认可,将加快实施Ⅱ期临床研究。
图4. PiCoVacc在恒河猴中的安全性评估 虽然SARS-CoV-2感染的恒河猴模型目前还不完善,但SARS-CoV-2感染的恒河猴引起COVID-19样的症状仍然能够支持研究者对SARS-CoV-2的研究。重要的是,在接种PiCoVacc的恒河猴中没有观察到ADE和免疫病理情况恶化现象。并且接种6ug PiCoVacc的恒河猴可以完全抵御SARS-CoV-2的挑战。这些结果证明了PiCoVacc在恒河猴中的安全性和有效性,共同为人SARS-CoV-2疫苗的临床开发提供了一条前进的道路。 新冠病毒灭活疫苗的I期临床试验已经开始,已有众多志愿者完成接种,初步结果显示疫苗安全性良好。公雪杰表示,在获得Ⅰ期临床有关的安全性数据后,由研究者和伦理委员会批准确定启动Ⅱ期临床研究。目前,此次项目的申办者和研究者已经达成共识,并获得了伦理委员会的认可,将加快实施Ⅱ期临床研究。 来源:ibioworld BioWorld
原文链接:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247498744&idx=4&sn=50767fa416cac09ae8c1d4f29dda9ca6&chksm=fbf60f2dcc81863b35a1bcbf204a042239448bc31bd23c9d527d98a0c00e64c747bb6dfdfe49#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn




