来源:BioArt
撰文 | 章台柳分化过程中,干细胞和前体细胞通过一系列命运决定来完善其特性,直到达成功能性的最终状态。谱系追踪(lineage tracing)是推断祖细胞和子代之间关系的金标准,即通常使用遗传手段对表达特定标记基因的祖细胞亚群进行标记,在后续时间点对其分化命运进行检测【1】。近期发展的单细胞测序技术(single-cell RNA sequencing,scSeq)能够捕获处于分化各个阶段的成熟细胞类型,可用于描述基因表达在空间上的“状态图谱(state map)”,为研究细胞状态的层次结构及随时间变化的基因表达动力学提供了工具【2】。
然而,无论是状态图谱还是谱系图谱都无法完整且系统地重现分化过程。虽然scSeq能以高分辨率描述细胞状态,但其无法将祖细胞的详细状态和其最终分化命运联系起来。而且,scSeq数据不能直接揭示祖细胞进入一个或多个命运的阶段,或有多少不同途径导致细胞达到相同的最终分化状态。scSeq的高维特性导致同一数据可以有多种方法构建细胞分化轨迹。所以,需要寻找新的方法将细胞详细的全基因组状态和长期的动态行为联系起来。
近日,来自哈佛医学院的Allon M. Klein在Science杂志发表文章Lineage tracing on transcriptional landscapes links state to fate during differentiation,报道了同时描绘细胞状态图谱和细胞命运图谱的新技术,即首先在细胞中表达“DNA条码”,然后随着时间的推移追踪转录组变化。将新技术应用于造血系统中命运决定的研究,成功鉴定了启动命运潜能的状态,鉴定出两条单核细胞分化路线。对姐妹细胞的分析显示,细胞具有内在的分化命运偏好,这是单细胞RNA测序无法检测到的。命运选择发生的时间早于基于状态图谱的最新算法推演的时间,且细胞分化的过程与假时间轨迹具有精确且一致的动力学特征。

研究人员同时检测细胞转录状态和细胞命运的策略是:利用遗传手段对异质性祖细胞群进行DNA条形码标记,部分细胞立即进行scSeq分析,部分细胞分裂分化后进行scSeq分析。DNA条形码结构是在一个普遍表达的EF1α启动子驱动的增强性绿色荧光蛋白基因的3’UTR区域插入一个随机的28bp片段组成,构建了DNA条形码库LARRY(lineage and RNA recovery)。随后利用改良后的慢病毒转染将可遗传的DNA条形码插入到基因组中,scSeq测序可检测到DNA条形码。
该技术可检测到3种克隆关系:1)在1次或2次分裂后可能捕获最早时间点的姐妹细胞;2)在早期和后期观察到的克隆,可将早期细胞的状态与其姐妹细胞的分化命运进行比较;3)在后期的分化细胞,将揭示不同分化命运之间的克隆关系。
研究人员利用该技术对小鼠的造血干细胞和祖细胞(HSPCs)的分化过程进行研究。体外研究首先分离出寡能(Lin-Sca-Kit+)和多能(Lin-Sca1+Kit+或LSK)祖细胞,并在支持多向分化的培养基中培养。条形码标记后,细胞培养第2天便于慢病毒整合及细胞分裂。然后一半细胞用于scSeq分析“早期状态early state”,一半细胞培养至第4天和第6天后取样并进行scSeq分析。小鼠体内移植试验的流程是:首先分离短期和长期造血干细胞(Lin-ScahiKit+),DNA条形码标记后培养2天,取出40%用于scSeq分析,剩余的移植到10只亚致死剂量辐照的小鼠中,1周和2周后取样用于scSeq。体外scSeq分析描绘出从多能祖细胞(multipotent progenitors,MPP)到9种成熟细胞的连续状态图,包括红细胞(Er)、巨核细胞(Mk)、嗜碱性粒细胞(Ba)、肥大细胞(Ma)、嗜酸性粒细胞(Eos)、中性粒细胞(Neu)、单核细胞(Mo)、浆细胞样树突状细胞(pDC),Ccr7+迁移性树突状细胞(migDC)和淋巴前体细胞(Ly),细胞克隆展现出多样化行为,如单系和多系分化、早期祖细胞的自我更新等。移植实验中,scSeq描述了从MPPs到Neu成熟的几个阶段、DCs、Mo、Er、B、T、Ba细胞的连续状态图,其中多种细胞内部具有异质性,如DCs细分为CD11+、CD8+、migDC、pDC等。
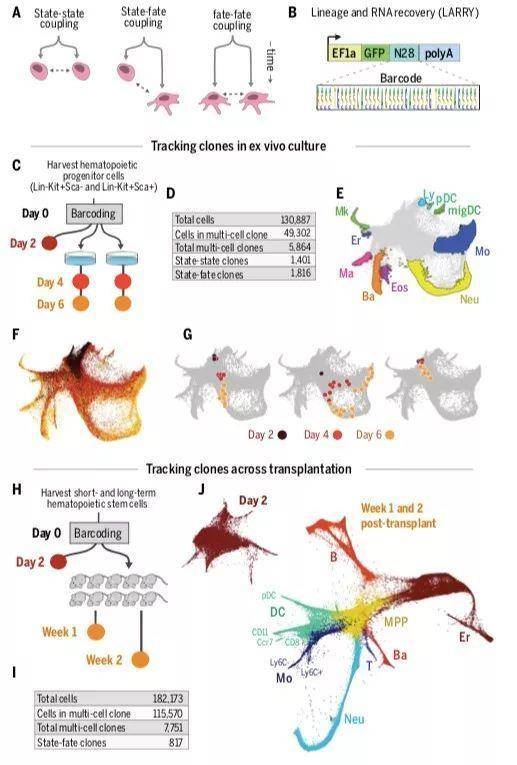
利用LARRY可以对单个细胞随时间变化进行研究,发现单系克隆定位在命运潜能的区域;多系克隆定位在不同分化命运的祖细胞重叠的区域,即命运决定的边界位置。具有不同分化命运潜能的前体细胞并没有分成离散的细胞状态,而是形成了一个具有结构的连续体。此外,双重潜能区域的形成扩展了命运边界,表明分化进程可以在某一段时间内独立于命运决定而发生。将基因表达和细胞命运分化潜能进行综合分析,体内和体外实验的scSeq数据都显示功能谱系分化的启动在连续的造血祖细胞群体中是变化的,而且随着基因的异质表达而共同表达,包括转录因子和其他功能性基因的变化,即细胞的谱系决定受到内在的谱系启动和环境因素共同影响。利用机器学习对基因表达是否可以预测细胞命运进行研究,发现HSPCs中差异表达的基因对细胞命运的预测力较转录因子要高,而且转录状态对细胞命运的最高预测率,体外为60%,体内为51%,即细胞自主转录状态对细胞命运影响的最低限。
对数据的进一步分析发现,相比于早期状态,4天或移植1周后的转录组对细胞命运的预测力更高,表明姐妹细胞间命运的高度一致性;体外培养或移植过程存在着影响细胞命运的可遗传细胞生理特性,在scSeq中无法被检测到。单核细胞分化具有两条不同途径:DC样和Neu样单核前体细胞分化而来,分别对应着近期鉴定的MDPs(Mo-dendritic progenitors)和GMPs(granulocyte- Mo progenitors)。经过分析验证了假时间分析用于捕获分化进程的准确性,而基于scSeq数据的数学模型不能全面地预测细胞的命运选择。
总的来说,研究开发了一种同时获得细胞转录状态图谱和谱系图谱的新技术,并展示了其在谱系追踪研究中强大的应用潜能,为研究细胞命运决定提供了新工具。
原文链接:
https://science.sciencemag.org/content/367/6479/eaaw3381
参考文献
1. P. Jensen, S. M.Dymecki, Essentials of recombinase-based genetic fate mapping in mice. MethodsMol. Biol. 1092, 437–454 (2014).2. C. A. Herring,B. Chen, E. T. McKinley, K. S. Lau, Single-cell computational strategies forlineage reconstruction in tissue systems. Cell. Mol. Gastroenterol. Hepatol. 5,539–548 (2018).来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652483515&idx=4&sn=c3b6e60488f883bb029f9466b09f7258&chksm=84e23c0fb395b5192dedf9c3ed5ad17d19e986806f65b3235be8524191451615f6af4ba73bf1#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



