Cell : 肠道神经元的“守护神”——肌层巨噬细胞
BioArt |
2020-04-06 09:51
来源:BioArt
撰文 | 胡小话
众所周知,胃肠道(gastrointestinal tract)是人体最重要的消化器官。可能很多人不知道的是,胃肠道在吸收营养物质的同时必须对食源性和微生物来源的抗原产生一定的耐受能力,帮助机体抵御病原体的入侵。因此,在胃肠道中占有很大比重的肠道神经元(Enteric-associated neurons, EANs)在病原体入侵时无疑会作为攻击的目标之一。临床数据显示,大约10%左右的细菌性肠胃炎患者会发展成肠易激综合征(irritable bowel syndrome,IBS),其临床表现为持续的轻微肠道炎症,胃肠道动力紊乱以及神经元的损伤【1】。然而,由肠道感染所引起的神经元损伤的具体机制却一直并不十分清楚。 近日,洛克菲勒大学的Daniel Mucida教授与Paul Muller团队在Cell上发表了题为Adrenergic Signaling in Muscularis MacrophagesLimits Infection-Induced Neuronal Loss 的研究,揭示了由Nlrp6和Caspase11所介导的肠道神经系统炎症反应是导致肠道神经元损失的主要原因,此外,他们的研究还表明,肌层巨噬细胞可以在感染发生时发挥保护作用。 这里值得一提的是,在同期的Cell杂志上还发表了一篇来自耶鲁大学医学院的研究文章,报道了EANs可以通过分泌IL-18协助构建肠道粘膜免疫屏障(详见BioArt报道:Cell | 肠道神经系统通过分泌IL18参与黏膜免疫屏障)【2】。
这里值得一提的是,在同期的Cell杂志上还发表了一篇来自耶鲁大学医学院的研究文章,报道了EANs可以通过分泌IL-18协助构建肠道粘膜免疫屏障(详见BioArt报道:Cell | 肠道神经系统通过分泌IL18参与黏膜免疫屏障)【2】。 这说明,肠道神经系统在宿主免疫中发挥的功能已经成为当前的一个研究热点。 急性的细菌感染已经被证明与感染后的IBS直接相关【3】,为了搞清楚其中具体的致病机制,作者首先利用一个无法在体内复制的鼠伤寒突变株(S. Typhimurium, spiB)构建了小鼠肠道感染的动物模型。作者发现,给小鼠口服spiB 7-10天之后,在粪便中几乎检测不到spiB存在,说明此时感染源已经被清除干净,但是温和的肠道炎症反应却是持续存在的。
通过检测小鼠胃肠功能的两个指标--回肠环肌收缩(ileal ring contractility)和胃肠通过时间(GITT),作者发现:伴随着肠道炎症的发生,小鼠的胃肠功能是下降的,而这两个指标在之前的报道中也被证明与肠内神经元(iEANs)的功能相关【4】。
通过进一步实验发现,从感染后第7天开始,一直到感染后第126天,小鼠回肠(ileum)和结肠(colon)iEANs数量下降了20%-30%,而作为对照的(一般不会被病原体入侵的)近端小肠(proximal smallintestine)和肠粘膜下丛(submucosalplexus)内iEANs 数量维持稳定,这说明iEANs损失可能是大部分感染后肠道共同的表型。有意思的是,作者发现用正常小鼠肠道菌去重构感染小鼠的肠道菌群可以回复由感染所致的iEANs损失。 而作者接下来的实验发现肠道感染只会导致兴奋性神经元亚群(VGLUT2+)损失,而抑制性神经元亚群(nNOS+和SST+)则不受影响,这说明肠道感染导致iEAN损失具有一定的亚群特异性。
那么,这类肠神经元损失的原因是什么呢?借助神经元特异的翻译核糖体亲和纯化的方法(translating ribosomal affinity purification, TRAP),作者发现Nlrp6,Pycard,Caspase1以及Caspase11等炎症复合体中蛋白的mRNA水平在感染之后的iEANs中显著上升,这提示:在感染发生时,由Caspase1/11介导的细胞死亡可能是导致iEANs损失的原因。通过构建一系列基因敲除的工具鼠,作者发现NLRP6和Caspase11是导致iEANs损失的主要效应蛋白。 作者之前的工作表明:组织原位的肌层巨噬细胞(Muscularis macrophages,MMs )可以通过分泌Retnla,Mrc1,cd163以及Il10等细胞因子发挥组织保护的功能【5】。那么肠道的MMs是否也可以在感染发生时保护iEANs呢?
作者发现用集落刺激因子受体抗体(α-CSF1R)去封闭MMs的功能的确可以加剧感染所致的iEANs损失。而进一步的研究则表明MM似乎是通过阻止iEANs的过度损伤而不是帮助其抵御病原体入侵来发挥保护功能的。作者之前的工作还发现β2肾上腺素受体(β2-AR)信号可以在肠道感染时促进MMs的功能,【5】于是作者用β2-AR的激活剂—salbutamol去处理感染后的小鼠发现也能起到保护iEANs的作用,这提示β2-AR信号很有可能是通过激活MMs来保护iEANs。这一结论最终在肠道MMs功能缺失的LysMΔAdrb2小鼠模型中得到了验证。
作者最后想回到的一个问题是:MMs中β2-AR信号是通过什么样的分子机制来发挥对iEANs的保护功能呢?精氨酸酶(Arginase1)是多胺合成通路中的一个关键蛋白,并且被报道可以抑制NLRP6介导的炎症信号通路的激活【6】。作者发现,感染后正常小鼠MMs中Arginase1转录水平是显著激活的,而在LysMΔAdrb2小鼠中则观察不到这一变化。此外,用DFMO抑制多胺合成可以加剧感染引起iEANs损失,而用spermine去饲喂老鼠则可以缓解这一过程,这些实验统统说明MMs中的β2-AR-Arg1-polyamines信号轴对于限制感染引起的iEANs损失发挥重要作用。
综上,Daniel Mucida教授的工作不仅阐明了肠道感染引起的神经元损失的具体机制,并且在之前研究的基础上揭示了肌层巨噬细胞可以在这一过程中通过β2-AR-Arg1-polyamines信号轴起到保护作用。同时这项工作提示我们,作为机体中主要的两个感知界面,神经系统和免疫系统存在着复杂的相互作用,并且不仅仅局限于肠道神经系统与肌层巨噬细胞之间,作者同时还类比了中枢神经系统与胶质细胞之间的关系。 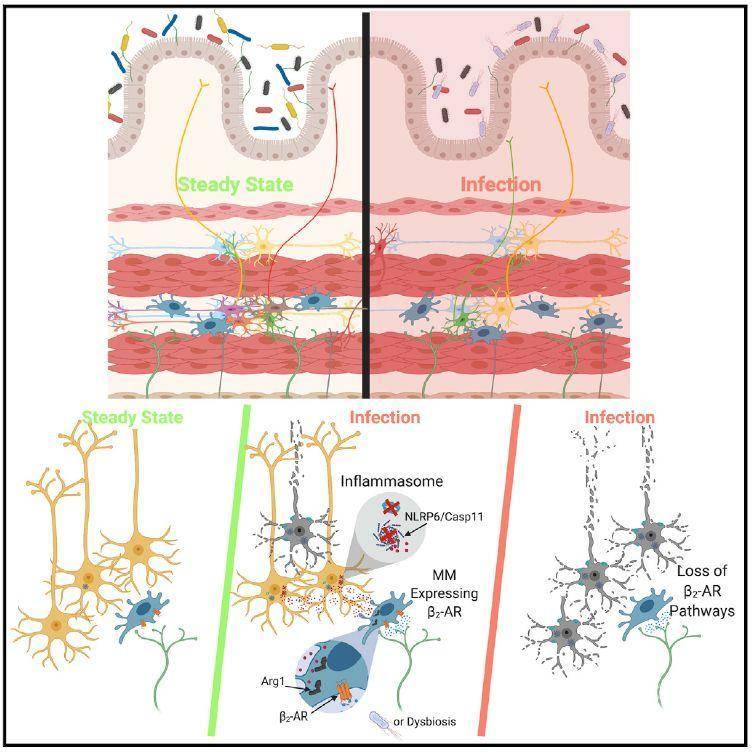
原文链接:
https://doi.org/10.1016/j.cell.2019.12.002
参考文献
1. Beatty, J.K., Bhargava,A., and Buret, A.G. (2014). Post-infectious irritable bowel syndrome:mechanistic insights into chronic disturbances following enteric infection. World J.Gastroenterol. 20, 3976–3985.
2. Jarret, A.et al. (2020).EntericNervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity. Cell180,50-63.3. Ohman, L., and Simre´n,M.(2010).Pathogenesis of IBS:role of inflammation, immunity and neuroimmuneinteractions. Nat.Rev.Gastroenterol.Hepatol. 7,163–173.4.
4. Travagli,R.A.,andAnselmi,L.(2016).Vagal neurocircuitry and its influence on gastric motility. Nat. Rev. Gastroenterol. Hepatol. 13,389–401.
5. Gabanyi, I., Muller,P.A., Feighery, L.,Oliveira, T.Y., Costa-Pinto, F.A., and Mucida,D. (2016).Neuro-immune Interactions Drive Tissue Programming in Intestinal Macrophages. Cell 164, 378–391.
6.Levy, M. et al. (2015).Microbiota-Modulated Metabolites Shape the Intestinal Microenvironment byRegulating NLRP6 Inflammasome Signaling. Cell163, 1428–1443.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482982&idx=5&sn=1cbcd4c16b3e3e4a914db859fd958ab8&chksm=84e23e12b395b704b31cd4366e22b6f7bb98d71ef4b6b58cf83c396b21bebbc1a015469a08d1#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn





