来源:BioArt
将近一个世纪前,德国科学家Von M. Hartmann发现如果每日切除单细胞生物阿米巴虫的一部分细胞质,使得细胞的尺寸小于一个临界值,阿米巴虫可以保持生长而上百天不分裂——一旦停止切除,细胞生长超过这个临界尺寸,就可以重新分裂【1,2】。后来的研究发现不仅是原生动物阿米巴虫,在其他生物系统里,也都存在细胞分裂的临界尺寸(critical size):细胞必须生长至大于该值,才能分裂。 临界尺寸可以用来解释另一个相关的现象,那就是细胞尺寸稳态。二十世纪七十年代,美国科学家Leland Hartwell分离研究芽殖酵母突变体,发现几乎所有细胞周期突变体(不能分裂)仍然能生长。因此他和大多数科学家认为细胞生长和细胞分裂是两个分离的系统,细胞生长和细胞分裂需要协同来保证细胞大小的稳态。他们提出了生长优先模型,细胞生长更基础,细胞分裂要适应细胞生长【3,4】。小细胞生长变大,大细胞分裂变小,这两个股对抗的力量使得细胞尺寸保持紧凑的分布——也就是达到了稳态。这个假说要求细胞能够“感知”自己的大小。 然而细胞如何感知尺寸的呢?遗传学家试图用突变体筛选的办法回答这个问题:如果一个突变体的细胞尺寸的分布和母本不一致,那么突变体中变异的基因也许就是控制细胞尺寸的基因。在细胞周期突变体发现之初,研究者就发现这些突变体的细胞尺寸与母本不一致:大多数细胞周期突变体较母本更大。在此之后,人们从裂殖酵母和芽殖酵母中筛选出更多的尺寸变大或者变小的突变体【5,6】。
这些突变体被称为尺寸控制突变体,而克隆获得的相应的基因被认为是用来感知和决定细胞尺寸的,也被称为细胞尺寸控制基因(cell size control genes)。 然而细胞尺寸控制基因如何控制细胞大小,仍然是个谜。在芽殖酵母中,经典的细胞尺寸控制基因有CLN3,BCK2,WHI5等等。
CLN3编码的蛋白Cln3是个细胞周期素(cyclin),可以控制细胞周期的关键控制因子——周期素依赖激酶(Cyclin-dependent kinase, CDK)的活性。在G1期细胞中,升高的CDK活性可以通过激活转录G1细胞周期素基因CLN1和CLN2导致其进一步的升高,形成正向反馈回路,激活一系列G1/S因子,促使细胞周期推进至DNA复制期——S期。Cln3对CLN1/CLN2的转录激活则是通过激活SBF复合体转录因子,抑制Whi5转录抑制因子,重塑染色质来完成的。目前对G1细胞尺寸控制的理解可以大致概括为Cln3对Whi5比值的上升:Cln3激活细胞周期推进,而Whi5抑制细胞周期推进,当细胞小于临界尺寸,抑制作用强于激活作用,随着细胞变大,抑制作用变弱,激活作用变强,最终激活战胜抑制,细胞周期推进。
然而如果追问在G1期,Cln3对Whi5的比值如何变化,因为两个蛋白质的浓度都非常低,精准测量十分困难,学界并没有统一答案。有些学者认为Cln3浓度上升【7,8】,有些认为保持不变【9-11】,有些认为Whi5浓度降低【11】,有些认为保持不变【12】。至于为什么Cln3和Whi5会有各自的表达特征以及Cln3和Whi5随着细胞尺寸的变化而变化机制是什么就更无从讨论。 退一步说,就算发掘了Cln3和Whi5随细胞尺寸变化的机制,我们仍然不能理解细胞尺寸控制:首先,对于细胞尺寸控制、协调生长和分裂这样基础的功能,横观其他生物系统,拥有Whi5和SBF这一套转录因子的仅限于部分真菌;其次,其他真菌貌似拥有完全不一样的细胞尺寸控制基因;更重要的,人为敲除了CLN3和/或者WHI5的芽殖酵母细胞貌似依然拥有临界尺寸【13】,只不过对于这些敲除突变体来说,临界尺寸变大或者变小了。
那么,细胞尺寸控制是如何工作的呢? 2020年4月3日,石溪大学的Bruce Futcher实验室(第一作者为陈于平博士,现在Stanford的Jim Ferrell组做博士后)在Molecular Cell上发表了文Differential Scaling of Gene Expression with Cell Size May Explain Size Control in Budding Yeast,揭示了酵母细胞是如何通过基因表达来“感知”尺寸大小,协调细胞生长和分裂,保持细胞尺寸的稳态。他们使用了多种手段测量细胞尺寸的分布,惊奇地发现32种经典的细胞尺寸突变体事实上保留着完好的细胞尺寸稳态,也就是说这些突变体仍然能够感知细胞尺寸,只不过它们的目标尺寸变化了。
通过分析已发表的对酵母全基因组敲除库的细胞尺寸的研究,他们发现几乎没有一个单基因敲除体完全失去了感知细胞尺寸的能力。由于酵母全基因组敲除库里不含有必须基因的纯合敲除,这项结果意味着细胞尺寸的感知是由必需基因决定的,亦或由多个基因协同完成。 
接着,他们分析了转录组对细胞尺寸的响应。他们使用淘析仪(一种靠物理方法分离不同大小的颗粒的仪器)获得了小的G1细胞,使用化学生物学的方法让细胞停滞在G1时期,并且让细胞保持继续生长。在此过程中,不同大小的细胞被抽样进行转录组分析。数据分析中,他们计算了每一个基因的尺寸响应度(size scaling),即mRNA浓度/细胞尺寸的斜率。尺寸响应度等于零,说明基因的表达量随细胞尺寸线性增加,浓度不变;大于零说明基因表达水平的增加速度快于细胞尺寸的增加速度,浓度变高;小于零则表达水平慢于细胞尺寸,被稀释。他们事先确定了8个细胞周期激活因子和8个细胞周期抑制因子。在多次试验中,每个激活因子的尺寸响应度几乎总是高于任意一个抑制因子。而在没有细胞尺寸变化的控制实验里,这种效应并不存在(图1)。这就意味着随着细胞长大,在转录水平上,一组细胞周期激活因子从整体上较抑制因子可以更快地升高。 图 1 每个基因的细胞尺寸响应度。(A),(B)和 (C)是几组有尺寸变化的试验。(D)是没有尺寸变化的对照组。红点表示细胞周期激活因子,绿点表示细胞周期抑制因子。
图 1 每个基因的细胞尺寸响应度。(A),(B)和 (C)是几组有尺寸变化的试验。(D)是没有尺寸变化的对照组。红点表示细胞周期激活因子,绿点表示细胞周期抑制因子。
这种细胞尺寸响应度的差异是否在蛋白水平也存在?他们使用Western blot和活体荧光显微技术测量了多个细胞周期激活因子和抑制因子的蛋白水平。由于一些细胞周期激活/抑制因子的蛋白浓度很低(比如每个细胞大约仅含有100个Cln3),普通的荧光蛋白不能产生足够的检测信号,并且需要花较长时间折叠蛋白产生信号,所以他们运用了多拷贝split-GFP的标记来放大信号以及提高时间解析度。这是科研工作者第一次在活细胞中观察到了野生型CLN3的蛋白表达量(图2)。通过研究蛋白水平和细胞大小的关系,他们发现在蛋白水平,CLN3和其他细胞周期激活因子的细胞尺度响应度也同样高于抑制因子。
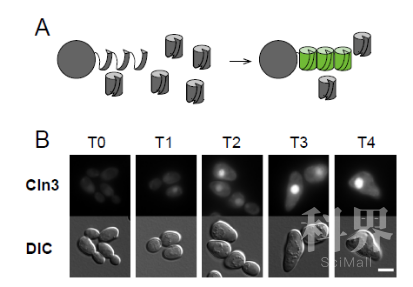 图 2 (A)多拷贝split-GFP和(B) Cln3蛋白量。
图 2 (A)多拷贝split-GFP和(B) Cln3蛋白量。
造成细胞尺寸响应度差异的机理是什么?他们提出了两个假说:1)激活因子和抑制因子的半衰期也许不同,而细胞的整体转录水平随着生长而升高,因此在这个过程中,激活因子因为半衰期短,而对细胞大小造成的转录水平升高更敏感,而抑制因子则相反,造成转录水平的差异;2)随着细胞变大,每份基因组上的转录因子呈线性关系增加,而由于转录因子之间的协同作用,细胞周期激活因子增长得比线性关系更快。通过基因组学研究,他们发现基因的细胞尺寸响应度和确实与mRNA半衰期相关,这一点支持了第一个假说。此外,他们发现控制细胞周期激活因子的转录激活因子的在细胞尺寸响应度高的基因上有更高的协同性,这一点支持了第二个假说。因此这两种机理可能同时影响细胞尺寸响应度。
由此,他们认为细胞尺寸的稳态来自于细胞周期激活因子和抑制因子的差异性表达。在这个过程中许多基因都参与了细胞尺寸的调控:当细胞偏小时“抑制因子队”占上风,随着细胞生长“激活因子队”越来越强,而抑制因子队越来越弱,当细胞达到临界尺寸的时候,激活因子队终于战胜抑制因子队,导致细胞分裂(图3)。稳态不来源于抑制因子队或激活因子队活力的绝对值:当任意一个队失去队员的时候,仅仅导致临界尺寸变化(图3)。如果要让细胞失去尺寸稳态,需要改变两队对尺寸的响应度(图3)。启动子交换的实验结果支持了这一假说:他们交换了一对激活因子和抑制因子的启动子,这将导致两队对尺寸的响应度的差异更小,与预期的结果一致,交换后细胞的尺寸稳态变弱了。

接着,他们分析了转录组对细胞尺寸的响应。他们使用淘析仪(一种靠物理方法分离不同大小的颗粒的仪器)获得了小的G1细胞,使用化学生物学的方法让细胞停滞在G1时期,并且让细胞保持继续生长。在此过程中,不同大小的细胞被抽样进行转录组分析。数据分析中,他们计算了每一个基因的尺寸响应度(size scaling),即mRNA浓度/细胞尺寸的斜率。尺寸响应度等于零,说明基因的表达量随细胞尺寸线性增加,浓度不变;大于零说明基因表达水平的增加速度快于细胞尺寸的增加速度,浓度变高;小于零则表达水平慢于细胞尺寸,被稀释。他们事先确定了8个细胞周期激活因子和8个细胞周期抑制因子。在多次试验中,每个激活因子的尺寸响应度几乎总是高于任意一个抑制因子。而在没有细胞尺寸变化的控制实验里,这种效应并不存在(图1)。这就意味着随着细胞长大,在转录水平上,一组细胞周期激活因子从整体上较抑制因子可以更快地升高。
 图 1 每个基因的细胞尺寸响应度。(A),(B)和 (C)是几组有尺寸变化的试验。(D)是没有尺寸变化的对照组。红点表示细胞周期激活因子,绿点表示细胞周期抑制因子。
图 1 每个基因的细胞尺寸响应度。(A),(B)和 (C)是几组有尺寸变化的试验。(D)是没有尺寸变化的对照组。红点表示细胞周期激活因子,绿点表示细胞周期抑制因子。这种细胞尺寸响应度的差异是否在蛋白水平也存在?他们使用Western blot和活体荧光显微技术测量了多个细胞周期激活因子和抑制因子的蛋白水平。由于一些细胞周期激活/抑制因子的蛋白浓度很低(比如每个细胞大约仅含有100个Cln3),普通的荧光蛋白不能产生足够的检测信号,并且需要花较长时间折叠蛋白产生信号,所以他们运用了多拷贝split-GFP的标记来放大信号以及提高时间解析度。这是科研工作者第一次在活细胞中观察到了野生型CLN3的蛋白表达量(图2)。通过研究蛋白水平和细胞大小的关系,他们发现在蛋白水平,CLN3和其他细胞周期激活因子的细胞尺度响应度也同样高于抑制因子。
 图 2 (A)多拷贝split-GFP和(B) Cln3蛋白量。
图 2 (A)多拷贝split-GFP和(B) Cln3蛋白量。造成细胞尺寸响应度差异的机理是什么?他们提出了两个假说:1)激活因子和抑制因子的半衰期也许不同,而细胞的整体转录水平随着生长而升高,因此在这个过程中,激活因子因为半衰期短,而对细胞大小造成的转录水平升高更敏感,而抑制因子则相反,造成转录水平的差异;2)随着细胞变大,每份基因组上的转录因子呈线性关系增加,而由于转录因子之间的协同作用,细胞周期激活因子增长得比线性关系更快。通过基因组学研究,他们发现基因的细胞尺寸响应度和确实与mRNA半衰期相关,这一点支持了第一个假说。此外,他们发现控制细胞周期激活因子的转录激活因子的在细胞尺寸响应度高的基因上有更高的协同性,这一点支持了第二个假说。因此这两种机理可能同时影响细胞尺寸响应度。
由此,他们认为细胞尺寸的稳态来自于细胞周期激活因子和抑制因子的差异性表达。在这个过程中许多基因都参与了细胞尺寸的调控:当细胞偏小时“抑制因子队”占上风,随着细胞生长“激活因子队”越来越强,而抑制因子队越来越弱,当细胞达到临界尺寸的时候,激活因子队终于战胜抑制因子队,导致细胞分裂(图3)。稳态不来源于抑制因子队或激活因子队活力的绝对值:当任意一个队失去队员的时候,仅仅导致临界尺寸变化(图3)。如果要让细胞失去尺寸稳态,需要改变两队对尺寸的响应度(图3)。启动子交换的实验结果支持了这一假说:他们交换了一对激活因子和抑制因子的启动子,这将导致两队对尺寸的响应度的差异更小,与预期的结果一致,交换后细胞的尺寸稳态变弱了。

图3 细胞尺寸控制模型。(A)正常细胞中细胞周期激活因子随细胞大小增加,抑制因子稀释。二者交点决定临界尺寸,细胞尺寸分布紧凑。(B)当一个细胞周期激活因子被敲除,交点右移,临界尺寸变大,细胞分布依然紧凑。(C)改变尺寸响应度,细胞分布松散。
总之,这篇文章提出学界广泛关注的尺寸控制基因并不控制细胞尺寸稳态。细胞稳态是由诸多基因伴随尺寸变化的差异表达造成的。和“Whi5稀释假说”【11】的观点一致,文章发现Whi5蛋白在G1期细胞生长的过程中浓度降低。然而,他们提出Whi5稀释仅仅是诸多伴随细胞尺寸变化的差异表达中的一个例子。伴随尺寸的差异表达可以用转录因子随细胞增大在DNA上富集来解释。“激活因子队”对抗“抑制因子队”的假说不仅能够解释芽殖酵母中细胞尺寸稳态和尺寸控制是如何达成的,还可以用来解释为什么进化中单个激活因子并不保守,以及为什么不同生物系统貌似使用完全不同的尺寸控制基因。“激活因子队”对抗“抑制因子队”的模型能否用来解释人类细胞的尺寸控制有待进一步的研究。原文链接:https://doi.org/10.1016/j.molcel.2020.03.012
参考文献
1.Hartmann, M., Über experimentelle Unsterblichkeit von Protozoen-Individuen. Naturwissenschaften, 1926. 14(19): p. 433-435.2.Jorgensen, P. and M. Tyers, How Cells Coordinate Growth and Division. Current Biology, 2004. 14(23): p. R1014-R1027.3.Hartwell, L.H., et al., Genetic control of the cell division cycle in yeast. Science, 1974. 183(4120): p. 46-51.4.Johnston, G.C., J.R. Pringle, and L.H. Hartwell, Coordination of growth with cell division in the yeast Saccharomyces cerevisiae. Exp Cell Res, 1977. 105(1): p. 79-98.5.Nurse, P., Genetic control of cell size at cell division in yeast. Nature, 1975. 256(5518): p. 547-51.6.Sudbery, P.E., A.R. Goodey, and B.L. Carter, Genes which control cell proliferation in the yeast Saccharomyces cerevisiae. Nature, 1980. 288(5789): p. 401-4.7.Thorburn, R.R., et al., Aneuploid yeast strains exhibit defects in cell growth and passage through START. Mol Biol Cell, 2013. 24(9): p. 1274-89.8.Zapata, J., et al., PP2ARts1 is a master regulator of pathways that control cell size. J Cell Biol, 2014. 204(3): p. 359-76.9.Tyers, M., G. Tokiwa, and B. Futcher, Comparison of the Saccharomyces cerevisiae G1 cyclins: Cln3 may be an upstream activator of Cln1, Cln2 and other cyclins. EMBO J, 1993. 12(5): p. 1955-68.10.Tyers, M., et al., The Cln3-Cdc28 kinase complex of S. cerevisiae is regulated by proteolysis and phosphorylation. EMBO J, 1992. 11(5): p. 1773-84.11.Schmoller, K.M., et al., Dilution of the cell cycle inhibitor Whi5 controls budding-yeast cell size. Nature, 2015. 526(7572): p. 268-72.12.Dorsey, S., et al., G1/S Transcription Factor Copy Number Is a Growth-Dependent Determinant of Cell Cycle Commitment in Yeast. Cell Syst, 2018. 6(5): p. 539-554.e11.13.Wang, H., et al., Recruitment of Cln3 cyclin to promoters controls cell cycle entry via histone deacetylase and other targets. PLoS Biol, 2009. 7(9): p. e1000189.来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482942&idx=5&sn=39dc92cfdad44c69d837b023fe353360&chksm=84e23ecab395b7dca8467ee667fcb9d376a982f1ea9e3cca5245597bdec540b5f9647b5d2aa1#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



