来源:X一MOL资讯
大环化合物广泛存在于药物分子、农用化学品、芳香化合物以及基础材料中,大多数情况下,其骨架内的取代基排列赋予其平面手性。目前,已经证实了天然产物萜烯和环肽中存在平面手性,同时药物分子中也出现越来越多的阻转异构现象(图1A)。因此,如何合成肽环烷已引起化学家越来越多的关注。然而,其合成方法仍颇具挑战,即必须形成刚性且有张力的大环,同时赋予优异的对映选择性。目前,有关阻转选择性的大环化合成仍很少,其合成方法可分为两种(图1B)。大多数方法是使用辅助剂通过非共价相互作用来调控无环前体的构象。另一种是在环烷形成过程中利用催化来诱导不对称,这种情况更加罕见。
生物催化对重要的手性结构单元(如仲醇和胺)的合成具有深远的影响。特别是动态动力学拆分(dynamic kinetic resolution, DKR),它是一种涉及过渡金属络合物催化底物(通常为仲醇或胺)的消旋化以及酶(通常为脂肪酶)选择性地酰化一种对映异构体以形成酯或酰胺,然后脱酰以获得所需的醇或胺(图1C)。
于是,加拿大蒙特利尔大学化学系Shawn K. Collins教授课题组设想是否可以将类似的方法应用于平面手性大环化合物的制备?不过,他们发现两种方法存在一定的差异(图1D)。首先,DKR中的酰化只是暂时的,此外加入过量的酰化剂可以提高反应的速率和收率;而在大环化过程产生酰化的最终产物,醇和酰化试剂之间的化学计量也是固定的。
其次,在没有仲醇的情况下,必须使用不同的消旋方法。近日,他们做出突破,利用脂肪酶CALB生物催化合成平面手性大环化合物,并且具有优异的收率和对映选择性,反应的官能团耐受性好,相关成果发表在Science 上。
鉴于丝氨酸水解酶南极假丝酵母脂肪酶B(Candida antarctica lipase B,CALB)在仲醇DKR中的成功应用,作者将其用于苄基二醇的大环内酯化来合成[13]对环芳烷(paracyclophane)(图2A)。对于未取代的苄基二醇(1a),能够以中等的产率分离出所需的非手性大环化合物3a。先前已经证实CALB可以促进大环化,于是作者考察了OMe取代的苄基二醇(1b)的环化,但是相应产物3b的产率仅为10%。此外,对苄基质子信号的变温核磁共振(VT NMR)分析显示信号在50 °C时合并。
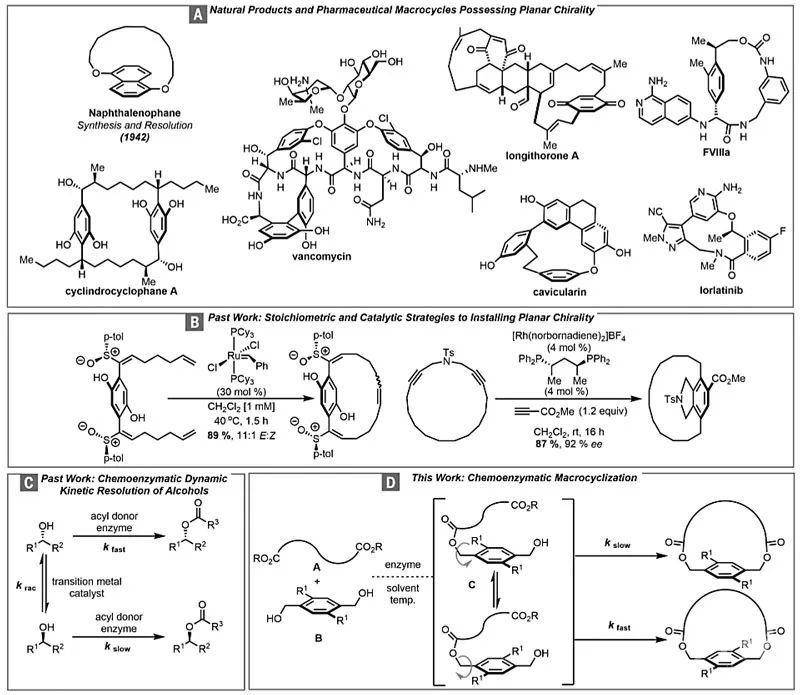
鉴于丝氨酸水解酶南极假丝酵母脂肪酶B(Candida antarctica lipase B,CALB)在仲醇DKR中的成功应用,作者将其用于苄基二醇的大环内酯化来合成[13]对环芳烷(paracyclophane)(图2A)。对于未取代的苄基二醇(1a),能够以中等的产率分离出所需的非手性大环化合物3a。先前已经证实CALB可以促进大环化,于是作者考察了OMe取代的苄基二醇(1b)的环化,但是相应产物3b的产率仅为10%。此外,对苄基质子信号的变温核磁共振(VT NMR)分析显示信号在50 °C时合并。
而使用较大的溴取代的苄基二醇(1c)进行大环化的收率更低,这很可能是由于邻位取代的苄基二醇与酶活性位点之间的空间位阻导致的。于是,作者尝试在苄基二醇的基础上增加一个亚甲基作为起始原料(5,图2B),发现能够以优异的收率和对映选择性得到所需的[14]对环芳烷6。6的苄基质子信号的VT NMR分析表明,即使在100 °C时,信号也不会合并。
尽管降低温度会降低6的收率,但升高温度并不会提高收率,也不会促进ansa-桥的旋转。为了进一步了解活化位点如何与环烷底物的不同构象结合,作者进行了计算对接(图2C)。先前曾报道过CALB结合到膦酸酯抑制剂(PDB ID 5GV5)上的X-射线晶体结构。
作者用大环的每个阻转异构体代替膦酸酯抑制剂,并考察了对接提示的结合模式。主要产物(-)-6的羧基指向附近的催化丝氨酸残基(Ser105),其中一个溴取代基指向活性位点的外部。在起始原料二溴二醇5的对接中,醇向具有催化活性的丝氨酸延伸,并可插入空腔中。实际上,即使是单酯化的中间体,其自身的羧酸酯也会朝向丝氨酸残基,溴取代基朝向活性位点内,其构象与所需环烷的构象相同。
接下来,作者就环的大小探索了底物范围。尽管可以通过使用带有6-亚甲基间隔基[-(CH2)6-]的二酸获得二溴环烷6,但将间隔基减少至4或5个亚甲基单元并不会显著增加环张力,并能以优良的收率和对映选择性获得期望的[12]和[13]对环芳烷(图3),同时也可以用其他取代基(如氯原子或碘原子)代替溴取代基。尽管卤素取代基的大小有所变化,但仍能以优异的收率和对映选择性得到所需的[12]、[13]和[14]对环芳烷(10→12)。
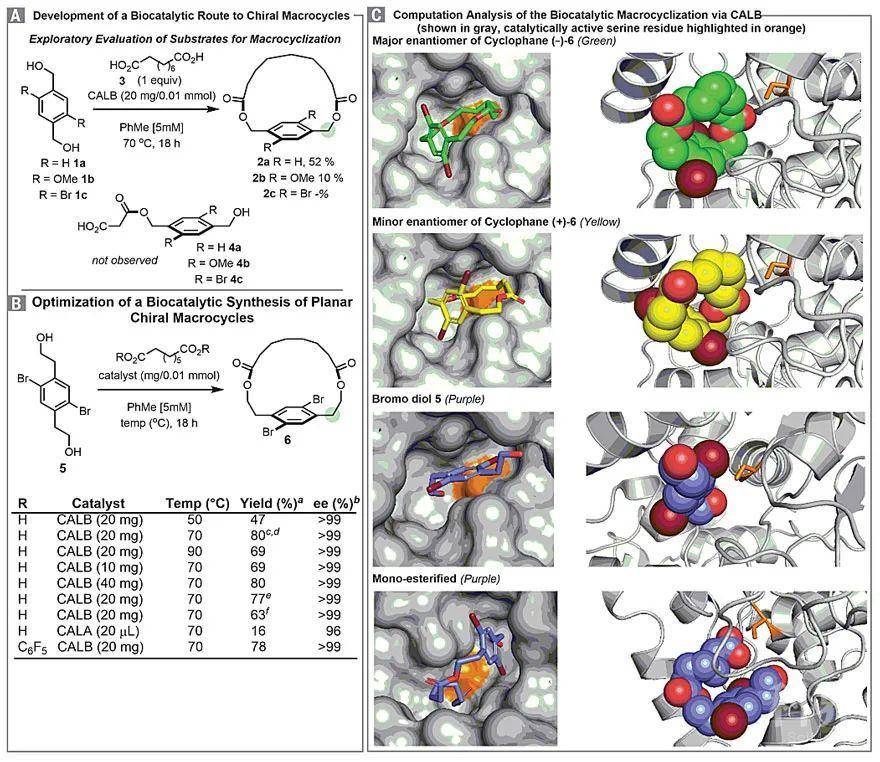
接下来,作者就环的大小探索了底物范围。尽管可以通过使用带有6-亚甲基间隔基[-(CH2)6-]的二酸获得二溴环烷6,但将间隔基减少至4或5个亚甲基单元并不会显著增加环张力,并能以优良的收率和对映选择性获得期望的[12]和[13]对环芳烷(图3),同时也可以用其他取代基(如氯原子或碘原子)代替溴取代基。尽管卤素取代基的大小有所变化,但仍能以优异的收率和对映选择性得到所需的[12]、[13]和[14]对环芳烷(10→12)。
此外,通过更多的亚甲基间隔基延长ansa-桥可以良好的收率获得[15]对环芳烷9,但是该产物为外消旋混合物,表明较大的脂肪环不再限制平面环烷的旋转。而较大尺寸的碘则可合成单一的对映体[15]对环芳烷17。
为了研究该酶的活性位点是否可以耐受更多官能化的ansa-桥,作者制备了两种不同的具有刚性1,3-二炔结构的大环,其核心分别被苯基和炔基取代(18和19),以及具有二硫键的[14]对环芳烷20,这是生物活性大环肽中常见的基序。在大环化过程中,一系列官能化的芳香二醇也具有良好的耐受性。基于三联苯环的大环化合物21以及对位茴香基和间位茴香基取代的环烷(分别为22和23)都能够以优异的对映选择性通过大环化形成。此外,还能够合成分别带有己炔基和苯炔基的[14]对环芳烷24和25。
大环化合物26中的杂原子官能团(如对甲基苯胺)也能耐受该反应,以高对映选择性形成C1对称的衍生物。另外,作者还合成出具有碘取代基和炔基单元的大环27,以及具有溴取代基和苄基单元的大环化合物28。
值得注意的是,含有卤素的平面手性大环化合物还可通过交叉偶联反应合成其他衍生物。例如,溴代环烷6可通过Miyaura硼化反应制备含有Bpin官能团的大环化合物29;也可通过Heck偶联以中等的收率和优异的对映选择性得到大环化合物30,尽管生物催化合成大环化合物30的选择性较高,但收率较低(19%)。
此外,其他的交叉偶联反应也可用于大环化合物的多样化:如溴代环烷6经Suzuki偶联可形成三联苯大环化合物21,而碘代环烷16经Sonogashira偶联以高收率得到了大环化合物25,且ee值保持不变,这表明即使在碱性水溶液下加热,大环化合物的稳定性仍很高。
总结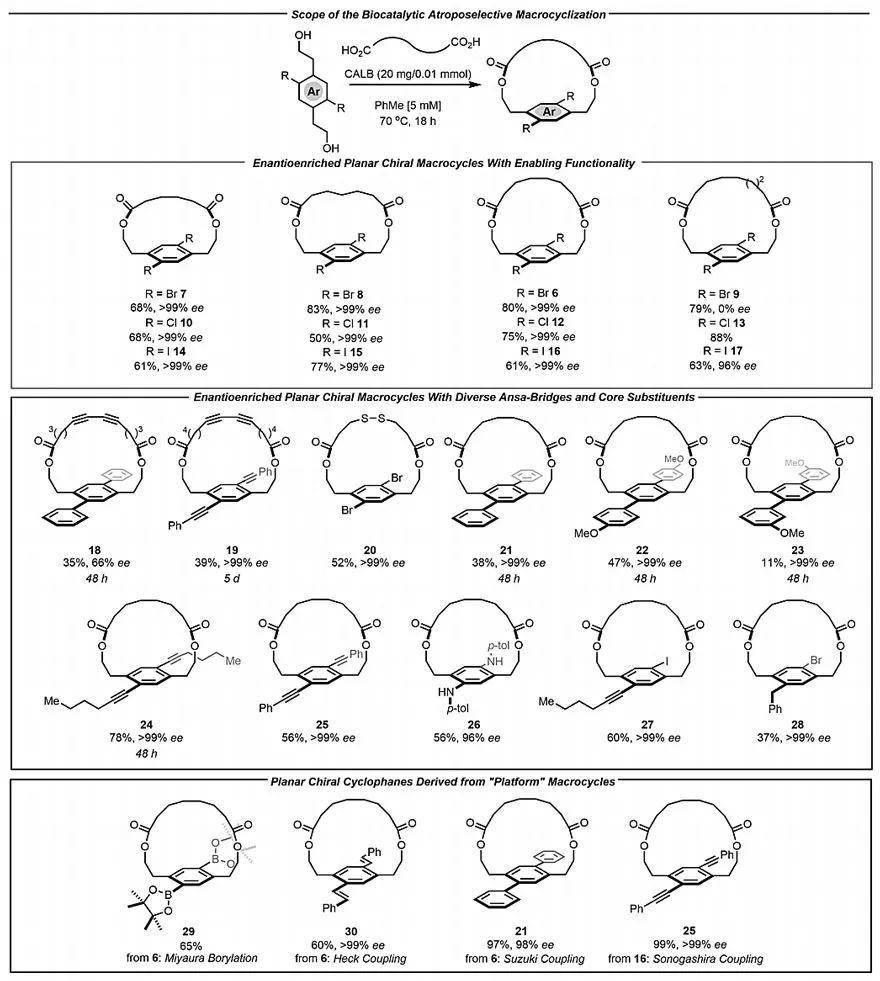
Shawn K. Collins教授课题组报道了一种新型的生物催化策略,即由简单的结构单元以优异的对映选择性合成平面手性大环化合物(对环芳烷),并可以耐受多种官能团。此外,含有卤素的平面手性大环化合物还可以进行一系列的交叉偶联反应。该策略为药物研发中制备平面手性化合物提供了新的解决方案。
原文:Biocatalytic synthesis of planar chiral macrocyclesChristina Gagnon, Éric Godin, Clémentine Minozzi, Johann Sosoe, Corentin Pochet, Shawn K. CollinsScience, 2020, 367, 917-921, DOI: 10.1126/science.aaz7381
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657631537&idx=2&sn=5c519dbe04cc2350ccbb4698adcac6c7&chksm=80f814e1b78f9df74094dd4b4616f1cc26ec64dd07a5cd31ae9ba63a6f0958e79c7e870543fb&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



