来源:纳米人
纳米医学在促进疾病的诊断和治疗方面显示出巨大的前景。当前,已经批准了许多基于纳米颗粒的递送系统用于肿瘤治疗,还有更多的处于临床试验或临床前评估中。然而,仍然存在临床转化的挑战,包括例如脱靶毒性,并且尽管进行了巨大的研究努力,但全身施用的纳米颗粒中只有极小部分(通常低于1%)可以被递送到实体瘤中。其余部分将有毒药物带到健康的组织和器官,导致脱靶毒性和有害副作用。因此,迫切需要探索新的策略,这些策略要么显示出更好的靶向性,要么根本不包含有毒药物。
根据Derjaguin、Landau、Verwey和Overbeek(DLVO)理论(图1a),纳米粒子的聚集状态非常依赖于长程静电斥力,它对粒子表面的电荷以及介质的离子强度和pH高度敏感。所有这些参数都可以调节以控制纳米粒子的聚集状态。而肿瘤微环境呈酸性(pH=6.5-6.9),溶酶体的内腔更酸(pH≈4.8)。因此,可根据DLVO理论,合理地设计纳米粒子的表面电荷,以在与细胞相互作用时控制其聚集行为。
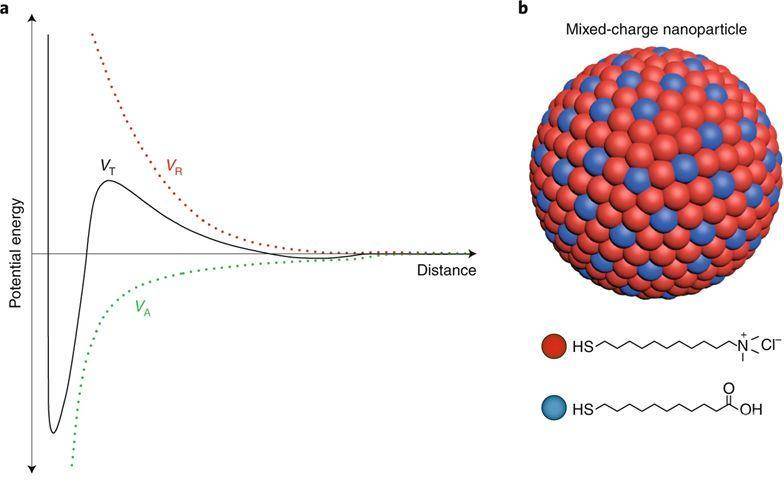
图1. DLVO理论和[+/-] NPs
成果简介:
有鉴于此,韩国基础科学研究所Bartosz A.Grzybowski和Kristiana Kandere-Grzybowska等人报道了一种“无药”策略,通过控制溶酶体中的携带两种电荷惰性金纳米颗的聚集状态来杀死癌细胞。
相关成果发表在Nature Nanotechnology上,且纳米界大佬乔治亚理工学院夏幼南教授应邀对此论文发表评述。
整体过程:
研究人员通过用不同比例的带正电的N,N,N-三甲基(11-巯基十一烷基)氯化铵(TMA)和带负电的11-巯基十一烷酸(MUA)修饰5 nmAu纳米颗粒的表面,以制备具有混合表面电荷的纳米颗粒[+/-] NP(图 1b),用于选择性靶向溶酶体,其中[+/-]NPs逐渐破坏溶酶体膜的完整性,最终在癌细胞中选择性地触发溶酶体依赖性细胞死亡。
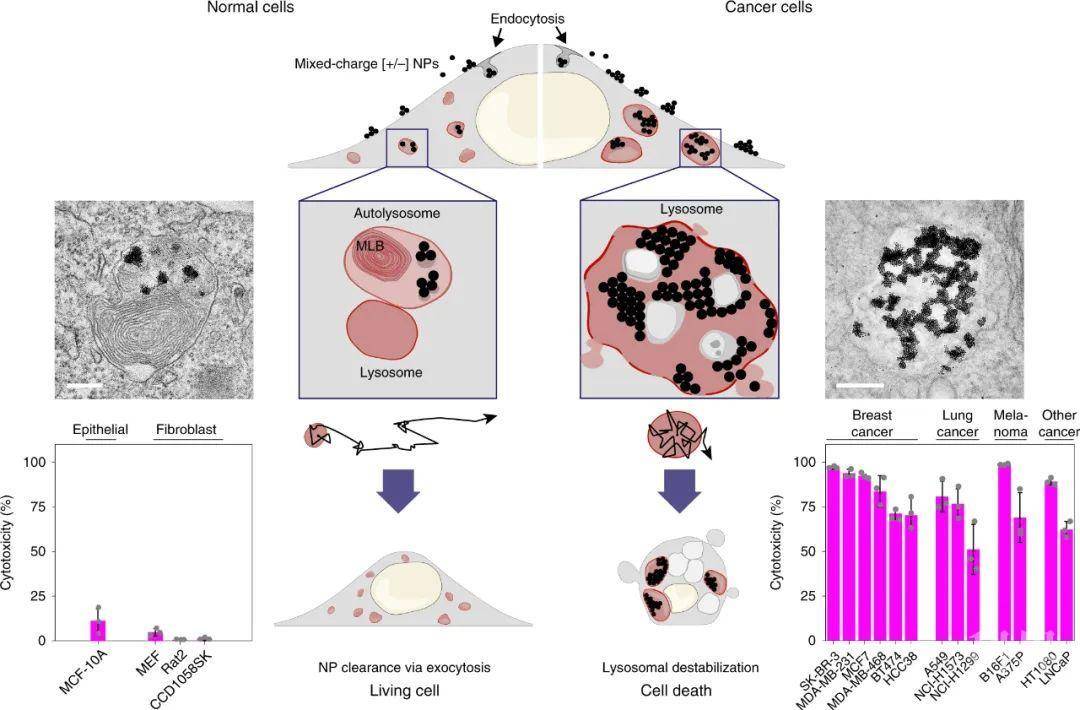
图2. 整体过程
这些影响源自一系列显著的转运和聚集现象:这些纳米粒子在pH = 7.4时分散良好,但在pH = 5.5–7时聚集成50–100 nm的团簇,然后在pH = 4.5–5.5时聚集成约2μm的超颗粒。值得注意的是,当与癌细胞一起培养时,这些纳米颗粒显示出类似的行为。它们在细胞表面(pH=6.5)迅速聚集成簇。然后形成的簇被内吞,然后在更酸性的溶酶体中聚集成超颗粒,诱导渗透流和溶酶体肿胀,溶酶体膜完整性逐渐丧失,最后导致细胞死亡。

图3. 癌细胞内级联聚集示意图
多用性:
值得注意的是,该策略适用于13种不同类型的癌细胞,包括肉瘤,乳腺癌,前列腺癌和肺癌,以及黑素瘤。相比之下,由于健康组织的中性细胞外环境,所测试的健康细胞不受影响。相反,纳米颗粒被胞吐作用清除,对正常细胞没有伤害。
为何需要正负混合纳米颗粒?
作者表明,只有TMA与MUA比率为4:1的纳米颗粒才能通过pH触发的聚集选择性杀死癌细胞。仅有阳离子配体的纳米颗粒对癌细胞和健康细胞均具有细胞毒性。
以下事实来解释:
1)纯阳离子纳米粒子可以通过直接的膜渗透轻松进入两种类型的细胞,从而使质膜可渗透。
2)不断增加阴离子配体量的纳米颗粒失去了细胞毒性,因为它们不易粘附在带负电的质膜上,因此难以被内在化。
小结:
从纳米技术的角度来看,这项研究可以被视为劫持一种癌细胞系统(内溶酶体)的一个相当独特的例子,利用癌细胞作为“纳米装配线”,逐渐构建高质量的NP晶体,这是一个很有意思的转化,即NP晶体最终破坏了本来培养它们长大的溶酶体“反应器”。
夏幼南教授最后客观地给出该技术几个面临的挑战:
尽管混合电荷纳米粒子在体外选择性杀死癌细胞方面的体外性能令人鼓舞,但要实现临床转化,还有很长的路要走。
1)首先,需要在体内证明其有效性,考虑到NPs的聚集对pH值高度敏感以及体内生物环境更加复杂,这将是一个重大挑战。
2)此外,疾病治疗后清除体内的金超微粒将是一个令人关注的问题。一种可能的替代方法是使用可生物降解的聚合物,然而,对聚合物纳米粒子表面进行精确的改性,以获得特定比例的混合表面电荷将增加新的挑战。
3)混合电荷纳米颗粒pH敏感聚集的机理仍需充分了解。正电荷配体、负电荷配体和蛋白质冠层的作用都有待进一步阐明和论证。
从体外数据来看,利用纳米颗粒的pH依赖性聚集选择性地杀死癌细胞为推进癌症治疗提供了一个有前景的策略,并且在不涉及与有毒药物相关的不良后果的情况下打开了潜在疾病治疗的大门。
参考文献:
1.Borkowska,M., et al. Targeted crystallization of mixed-charge nanoparticles in lysosomesinduces selective death of cancer cells. Nat. Nanotechnol. (2020).https://doi.org/10.1038/s41565-020-0643-3
2.Qiu,J., Xia, Y. Killing cancer cells by rupturing their lysosomes. Nat.Nanotechnol. (2020). https://doi.org/10.1038/s41565-020-0639-z
来源:nanoer2015 纳米人
原文链接:https://mp.weixin.qq.com/s?__biz=MzUxMDg4NDQ2MQ==&mid=2247518794&idx=2&sn=8b4612e0bf8664f3f6b1688f285bf7df&chksm=f97ee548ce096c5e87b1a55b49bd2f3bbdc3f8299fca0addeeed95e1ba57b7f2b5fa03a4e269#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



