来源:BioArt
核小体是构成染色质的基本结构单位,使得染色质DNA和蛋白质组织成为一种致密的结构形式。核小体由核心颗粒(core particle)和连接区DNA(linker DNA)二部分组成,在电镜下可见其成捻珠状,前者包括组蛋白H2A,H2B,H3和H4各两分子构成的致密八聚体(又称核心组蛋白),以及缠绕其上1.75圈长度约146bp的DNA链;后者包括两相邻核心颗粒间的连接DNA和位于连接区DNA上的组蛋白H1。这中串珠状的结构经过进一步反复折叠缠绕完成对基因组DNA的包装【1】。在基因的转录、复制过程中,这种高度折叠状态的染色质结构会被有序解开以及重新组装,越来越多的研究表明,组蛋白的翻译后修饰在这一过程中起着至关重要的作用【2】。
组蛋白H2B的单泛素化修饰就是组蛋白多种修饰中的一种,在调控基因转录方面起着重要的作用,通常H2Bub分布在活性转录的基因区域。但是到目前为止,参与H2Bub修饰的酶如何在特定的时间以及空间上对组蛋白进行翻译后修饰仍不明确【3】。
2020年3月11日,来自澳大利亚Medical University of Vienna 的Alwin Köhler课题组在Nature杂志发表了题为Phase separation directs ubiquitination of gene-body nucleosomes的文章,从相分离的角度阐述了H2Bub修饰发生的分子机制。
在前期的研究中发现Bre1, Rad6和Lge1对于H2Bub修饰具有重要的作用,传统的观点认为,Rad6-Bre1可以直接与RNA polymerase (Pol) II相互作用,进而促进转录活性区域的H2B发生单泛素化修饰,但是仍然不能解释H2Bub在基因组上非转录区域的定位。Bre1, Rad6, 和Lge1三个蛋白中,其中Bre1是E3泛素连接酶, Rad6作为E2泛素连接酶参与对H2B单泛素化修饰,作者课题组在2015年,2016年解析了Rad6-Bre1对H2B修饰的结构基础【4,5】。但是对于Lge1的功能仍不明确。
在前期的研究中发现Bre1, Rad6和Lge1对于H2Bub修饰具有重要的作用,传统的观点认为,Rad6-Bre1可以直接与RNA polymerase (Pol) II相互作用,进而促进转录活性区域的H2B发生单泛素化修饰,但是仍然不能解释H2Bub在基因组上非转录区域的定位。Bre1, Rad6, 和Lge1三个蛋白中,其中Bre1是E3泛素连接酶, Rad6作为E2泛素连接酶参与对H2B单泛素化修饰,作者课题组在2015年,2016年解析了Rad6-Bre1对H2B修饰的结构基础【4,5】。但是对于Lge1的功能仍不明确。
作者分析Lge1的结构发现,Lge1蛋白在其N端具有较长的一段Intrinsic disordered region (IDR),提示了该蛋白可能会发生相分离现象。作者首先在体外纯化了Lge1蛋白,发现Lge1确实能够发生相分离,并且这种相分离现象依赖于Lge1的IDR区域。有趣的是,当作者将Bre1加入到Lge1形成的“液滴”中的时候,Bre1会包被在Lge1所形成的“液滴”状结构外围,并不会进入液滴内部。进一步的研究发现,这种包被在在Lge1所形成的“液滴”状结构外围的Bre1蛋白能够募集Rad6以及核小体串进入Lge1所形成的“液滴”状结构,并进入液滴内部。因此,作者推测是否这种Bre1包被在Lge1所形成的“液滴”外围的这种结构能够为H2B单泛素化的发生提供了一个反应场所?
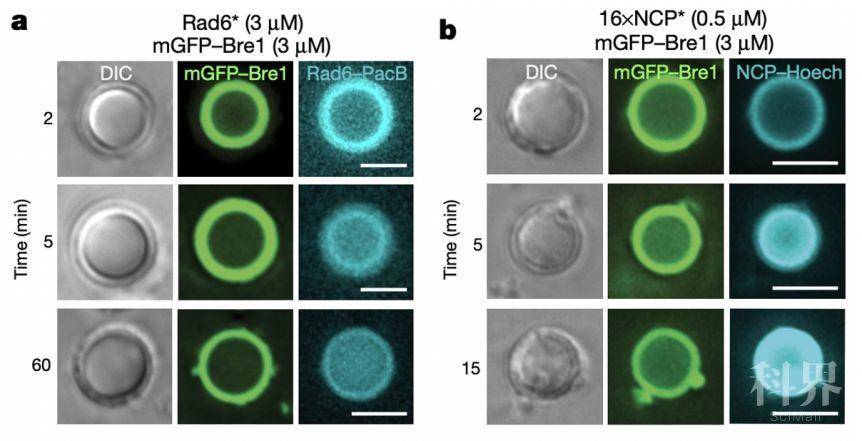
作者检测了这种相分离是否会影响H2B的单泛素化修饰,作者发现,全长的Lge1能够显著促进H2B的单泛素化修饰,但是无IDR区域的截断体(不发生相分离)没有该效果,单独的IDR区域也无法促进H2B的单泛素化修饰。因此,在体外,由Lge1–Bre1 通过Lge1的相分离形成的core–shell condensates能够显著促进H2B的单泛素化修饰。

作者检测了这种相分离是否会影响H2B的单泛素化修饰,作者发现,全长的Lge1能够显著促进H2B的单泛素化修饰,但是无IDR区域的截断体(不发生相分离)没有该效果,单独的IDR区域也无法促进H2B的单泛素化修饰。因此,在体外,由Lge1–Bre1 通过Lge1的相分离形成的core–shell condensates能够显著促进H2B的单泛素化修饰。
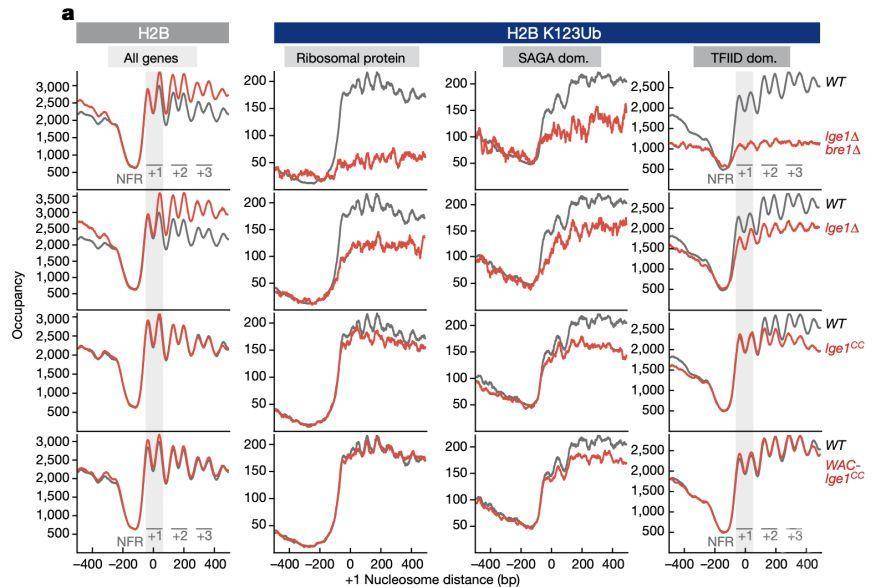
那么这种core–shell condensates是否具有生物学意义?作者在首先在细胞内检测了是否仍然存在这种结构。作者通过蔗糖密度梯度离心实验证实,在体内Bre1能够与Lge1仪器存在于高分子量区域,当敲除Lge1、截断其IDR区域、截断Bre1相互作用区域后,Bre1将只存在于低分子量区域。另外,通过荧光实验以及BiFC实验证实,Lge1与Bre1在细胞内具有较好的共定位,并且能够形成punca结构,并且这种结构的形成依赖于IDR区域,当用1,6-己二醇处理后这种punca明显减弱。因此,Lge1与Bre1在细胞内也能够发生相分离现象。接下来作者检测了体内的这种结构能够促进组蛋白H2B的单泛素化修饰。为了证实Lge1–Bre1 通过Lge1的相分离形成的core–shell condensates能够显著促进H2B的单泛素化修饰,作者在这一部分设计了系列的实验。
首先:1. 作者发现,与体外实验结果一致的是,当截断Lge1的IDR区域后,细胞内的H2BK123ub水平明显降低;2. 通过ChIP-exo实验证实,当截断Lge1的IDR区域后,H2BK123ub在+1 nucleosomes下游区域上的occupancy显著降低;3. 作者发现,LAF1 (amino acids 1–169)的IDR区域不能RESCUE Lge1-IDR-del的功能,但是人源的WAC (amino acids 1–318) IDR区域可以部分RESCUE Lge1-IDR-del的功能。另外,作者通过genetic assays证实了Lge1–Bre1 通过Lge1的相分离形成的core–shell condensates 对于htz1∆ 酵母的生长起着重要的作用。
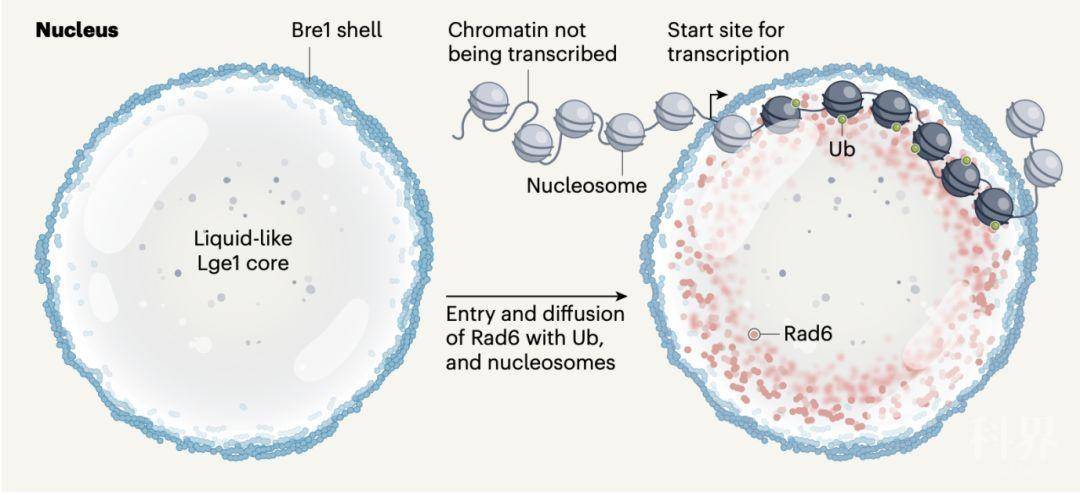
综上,作者通过体外以及体内的实验,提供了一种全新的相分离的模式。Lge1通过相分离形成“液滴状”结构,Bre1包被在Lge1形成的“液滴”外层,形成一种包被状的结构,这种结构能够募集E2 Rad6以及核小体串,提高局部的浓度,并为后续的泛素化修饰提供了一个有序的反应场所。
在这篇文章中,作者证明了该种形式的相分离对于H2B单泛素化修饰的重要性,也证实了能够影响细胞的存活,但是并未提供直接的证据,这种相分离的异常影响了H2B的单泛素化修饰是否影响了下游基因的转录?酵母Bre1蛋白在人类中同源的蛋白是的RNF20/RNF40,同样,RNF20/RNF40能够与WAC蛋白共同纯化。WAC蛋白是否在人类中也具有与酵母Bre1相似的功能?目前的一些研究已经发现WAC的突变或者阶段能够导致一些神经系统相关疾病的发生,那么是否这种形式的相分离的异常是导致这一类神经系统疾病的原因,还需要进一步的研究去证实。另外,别的一系列的组蛋白修饰的Writer, Eraser , Reader是否也具有相似的机制也值得进一步研究。
2.A. J. Bannister, T. Kouzarides, Regulation of chromatin byhistone modifications. Cell Res 21, 381-395 (2011).3.V. M. Weake, J. L. Workman, Histone ubiquitination:triggering gene activity. Molecular cell29, 653-663 (2008).4. E. Turco, L. D. Gallego, M. Schneider, A. Köhler,Monoubiquitination of histone H2B is intrinsic to the Bre1 RING domain-Rad6interaction and augmented by a second Rad6-binding site on Bre1. J Biol Chem 290, 5298-5310 (2015).5. L. D. Gallego et al.,Structural mechanism for the recognition and ubiquitination of a singlenucleosome residue by Rad6-Bre1. Proc Natl Acad Sci U S A 113, 10553-10558 (2016).

综上,作者通过体外以及体内的实验,提供了一种全新的相分离的模式。Lge1通过相分离形成“液滴状”结构,Bre1包被在Lge1形成的“液滴”外层,形成一种包被状的结构,这种结构能够募集E2 Rad6以及核小体串,提高局部的浓度,并为后续的泛素化修饰提供了一个有序的反应场所。

在这篇文章中,作者证明了该种形式的相分离对于H2B单泛素化修饰的重要性,也证实了能够影响细胞的存活,但是并未提供直接的证据,这种相分离的异常影响了H2B的单泛素化修饰是否影响了下游基因的转录?酵母Bre1蛋白在人类中同源的蛋白是的RNF20/RNF40,同样,RNF20/RNF40能够与WAC蛋白共同纯化。WAC蛋白是否在人类中也具有与酵母Bre1相似的功能?目前的一些研究已经发现WAC的突变或者阶段能够导致一些神经系统相关疾病的发生,那么是否这种形式的相分离的异常是导致这一类神经系统疾病的原因,还需要进一步的研究去证实。另外,别的一系列的组蛋白修饰的Writer, Eraser , Reader是否也具有相似的机制也值得进一步研究。
原文链接:
https://doi.org/10.1038/s41586-020-2097-z
参考文献
1.J. R. Dixon, D. U. Gorkin, B. Ren,Chromatin Domains: The Unit of Chromosome Organization. Molecular cell 62,668-680 (2016).2.A. J. Bannister, T. Kouzarides, Regulation of chromatin byhistone modifications. Cell Res 21, 381-395 (2011).3.V. M. Weake, J. L. Workman, Histone ubiquitination:triggering gene activity. Molecular cell29, 653-663 (2008).4. E. Turco, L. D. Gallego, M. Schneider, A. Köhler,Monoubiquitination of histone H2B is intrinsic to the Bre1 RING domain-Rad6interaction and augmented by a second Rad6-binding site on Bre1. J Biol Chem 290, 5298-5310 (2015).5. L. D. Gallego et al.,Structural mechanism for the recognition and ubiquitination of a singlenucleosome residue by Rad6-Bre1. Proc Natl Acad Sci U S A 113, 10553-10558 (2016).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482464&idx=5&sn=b842676e8df67a0b05d6377ce04e59d5&chksm=84e23814b395b102521de35b8553ace365f7c450b7f38a906a5886e9f7221ef808234ab51836#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



